19. 05. 2021
Temat: Stężenie procentowe roztworu – zadania tekstowe.
*
Witam Was Dzieci!
*
Lekcja na platformie.
Powtarzamy, i dodajemy nowe treści. Obejrzyjcie filmik
*
Podręcznik, strona 191
Zad. 2
- Cp = 2%
- masa roztworu = 80 g
- masa substancji = ?
- podstawiamy do wzoru: ms = Cp * mr / 100%
- ms = 2 * 80 / 100%
- ms = 1,6 g
Zad. 5
- mr = 0,5 kg = 500 g
- Cp = 4 %
- ms = ?
- obliczamy
- ms = 4 * 500 / 100 %
- ms = 20 g
- dosypujemy 20 g soli
- zmieniła się masa substancji oraz masa roztworu, do starego roztworu dosypaliśmy więcej substancji
- nowa ms = 20 g + 20 g = 40 g
- nowa mr = 500 g + 20 g = 520 g
- obliczamy nowe Cp
- Cp = ms * 100% / mr
- Cp = 40 * 100% / 520
- Cp = 7,7 %
*
Praca domowa
- zad. 6 / 191
- zad. 5 / 194
*
Pozdrawiam 🙂
*
17. 05. 2021
Temat: Stężenie procentowe roztworu.
*
Po lekcji na teamsach.
- powtórzyliśmy rozpuszczalność, wykorzystanie krzywych rozpuszczalności do obliczania rozpuszczalności różnych substancji w określonej temperaturze
- stężenie procentowe – wzory, zależności, zadania
- zad. 1, 3 / 191
- przeanalizujcie przykłady z podręcznika strony 185 – 189
*
Pozdrawiam 🙂
*
12. 05. 2021
Temat: Rozpuszczalność substancji w wodzie – zadania.
*
Witam Was Dzieci!
Dzisiaj lekcja na platformie.
Do obliczeń będą nam potrzebne krzywe rozpuszczalności – podręcznik strona 178 – 179
Przypominam – rozpuszczalność to maksymalna liczba gramów danej substancji rozpuszczona w 100 g rozpuszczalnika w danej temperaturze i danym ciśnieniu, aby otrzymać roztwór nasycony.
*
Filmik z poprzedniej lekcji, wykresy były omówione.
Zad. 1 / 183
odczytujemy rozpuszczalność, szukamy azotanu (V) potasu
szukacie , przez jaką wartość , ilości substancji , przebiega krzywa odpowiedniego związku
- 15 stopni, to 30 g w 100 g wody
- 60 stopni, to 110 g w 100 g wody
Zad. 2 / 183
odczytujemy rozpuszczalność z krzywej rozpuszczalności
- temp. 70 stopni, azotan (V) sodu rozpuszczalność 136 g w 100 g wody
- możemy ułożyć proporcję
- w 100 g wody mamy 136 g azotanu ; to w 200 g mamy x
- a więc x = 272 g
Zad. 3 / 183
jodek potasu, odczytujemy rozpuszczalność z krzywej rozpuszczalność
- w 10 stopniach = 135 g
- w 30 stopniach = 152 g
- ile gramów trzeba dodatkowo rozpuścić?
- odejmujemy
- 152 g – 135 g = 17 g
Przeanalizujcie przykłady z podręcznika, strony 181 – 182
*
Praca domowa, w zeszycie :
- zad. 2, 3, 4 / 194
- zad. 4 / 183
*
To wszystko, pozdrawiam 🙂
*
10. 05. 2021
Temat: Sprawdzian wiadomości z działu: ” Woda i roztwory wodne”.
*
05. 05. 2021
Temat: Rozpuszczalność substancji w wodzie.
*
Witam Was!
*
Po lekcji na teamsach.
- definicja rozpuszczalności
- rozpuszczalność substancji – stałych i gazów – w zależności od wzrostu temperatury
- obejrzyjcie filmik
*
powtórzenie przed sprawdzianem – omówiliśmy zakres na test na lekcji
- definicje
- rodzaje roztworów, mieszaniny
- właściwości cząsteczki wody
- woda jako rozpuszczalnik
- trzy stany skupienia wody
- ….
- ….
- powtórz – strony 160 – 177, 180
- test – 20 pytań, 20 minut
*
Powtarzajcie, proszę o samodzielną pracę. Pozdrawiam 🙂
*
28. 04. 2021
Temat: Rodzaje roztworów.
*
Witam Was Dzieci!
*
Dzisiaj lekcja na platformie.
*
Jak zawsze – zapoznajcie się z lekcją, filmikami, pamiętajcie o notatkach.
- roztwór – to mieszanina jednorodna co najmniej dwóch składników – substancji rozpuszczonej i rozpuszczalnika
- roztwór nienasycony – to taki, w którym przy danej temperaturze i w danej objętości rozpuszczalnika można rozpuścić jeszcze pewna ilość substancji
- roztwór nasycony – w danej temperaturze i danej objętości rozpuszczalnika nie można rozpuścić już więcej danej substancji; substancja opada na dno naczynia
- krystalizacja – wydzielanie substancji rozpuszczonej z roztworu; np wskutek oziębiania roztworu
- obejrzyjcie filmik
- podział mieszanin ze względu na ilość substancji rozpuszczonej:
- roztwór nasycony
- roztwór nienasycony: roztwór rozcieńczony i roztwór stężony [ samodzielnie – opisz ]
- podział mieszanin ze względu na wielkość cząstek:
- roztwór właściwy, koloid, zawiesina
*
Na dzisiaj to wszystko, zapoznajcie się dokładnie z przedstawionymi wiadomościami.
Pozdrawiam 🙂
*
26. 04. 2021
Temat: Woda jako rozpuszczalnik.
*
Witam Was Dzieci!
*
Po lekcji na teamsach.
- sprawdzenie notatki z poprzedniej lekcji
- powtarzamy i rozszerzamy nasze wiadomości
- filmik
- oglądajcie dalej
- woda występuje w przyrodzie w trzech stanach skupienia: stałym, ciekłym i gazowym – te oraz inne właściwości już na pewno opisaliście w notatce
- oglądamy – powtarzamy
- Woda jest bardzo dobrym rozpuszczalnikiem dla większości ciał stałych oraz dobrze miesza się z wieloma innymi cieczami. W cząsteczce wody występują wiązania kowalencyjne spolaryzowane. To, że woda jest bardzo dobrym rozpuszczalnikiem wynika to z budowy polarnej jej cząsteczek, które są tzw. dipolami:
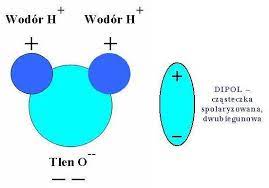
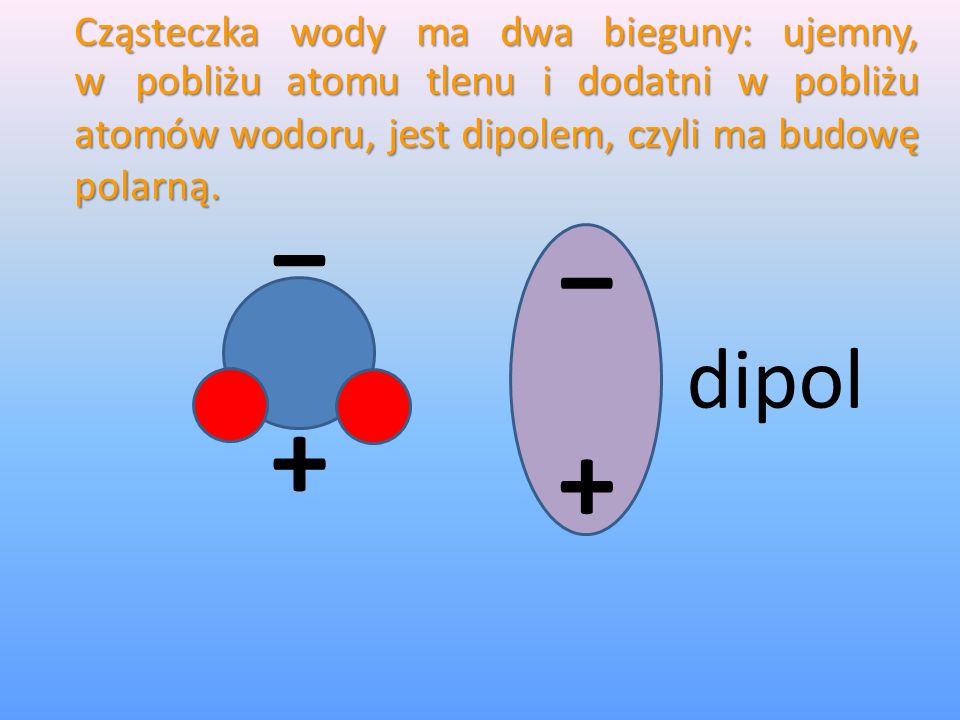
- w wodzie dobrze rozpuszczają się związki o budowie jonowej czyli takie, których cząsteczki zawierają kationy i aniony. Rozpuszczanie polega na takim ustawieniu się cząsteczek, ze dodatni biegun cząsteczki wody styka się z jonem ujemnym cząsteczki substancji rozpuszczonej, natomiast biegun ujemny cząsteczki wody z jonem dodatnim cząsteczki rozpuszczonej
- co to jest rozpuszczanie ? [ definicja, opis – samodzielnie ]
- od czego zależy szybkość rozpuszczania substancji: [ omawialiśmy na lekcji – samodzielnie ]
*
Pamiętajcie o notatce w zeszycie – konkretnej, szczegółowej.
To wszystko do tej lekcji, pozdrawiam 🙂
*
21. 04. 2021
Temat: Woda – właściwości i rola w przyrodzie.
*
Witam Was!
*
Lekcja na platformie, proszę o notatkę.
Zaczniemy od filmiku
*
Lekcja łatwa, znana Wam z życia codziennego, to również wiadomości poznane na innych przedmiotach.[ podręcznik strony 160 – 164 ]
Do czego potrzebna jest woda?
- procesy zachodzące w środowisku przyrodniczym
- procesy chemiczne – obecność wody niezbędna
- schładzanie – procesy związane z przemysłem
- obecność wody w organizmach żywych – funkcjonowanie organizmów żywych
Główne źródła zanieczyszczeń wody
- zanieczyszczenia komunalne
Właściwości wody
- woda zwiększa swoją objętość podczas zamarzania [ opisz ….]
- anomalia – gęstość wody w temperaturze 4 stopni C [ opisz … ]
- różna temperatura wrzenia – jaki wpływ ma ciśnienie [ wyjaśnij … ]
Jak możemy oszczędzać wodę – gospodarka racjonalna
W poniedziałek porozmawiamy na teamsach. Pozdrawiam 🙂
*
19. 04. 2021
Temat: Sprawdzian: ” Łączenie się atomów. Równania reakcji chemicznych.”
*
14. 04. 2021
Temat: Podsumowanie wiadomości o łączeniu się atomów i reakcjach chemicznych.
*
Witam ponownie!
*
Po lekcji na teamsach.
Powtórzenie przed sprawdzianem. Dwie części – pamiętajcie.
W pliku w zespołach na teamsach jest whiteboard 37.
Pozdrawiam 🙂
*
12. 04. 2021
Temat: Obliczenia stechiometryczne.
*
Witam Was Dzieci!
*
Po lekcji na teamsach.
- sprawdziliśmy , omówiliśmy karty pracy – równania reakcji chemicznych i prawo zachowania masy
- zadania – obliczenia stechiometryczne – wykorzystanie mas atomowych i cząsteczkowych do obliczenia masy substratu lub produktu
- dodatkowa chemia – środa
*
Powtórzenie przed sprawdzianem
- rodzaje wiązań chemicznych
- wiązania występujące w różnych związkach
- oktet elektronowy – definicja, co oznacza dla pierwiastka
- definicje: wiązanie, kation, anion, wspólna para elektronowa itp
- wartościowość
- typy reakcji chemicznych
- odczytywanie wzorów chemicznych
- zapisywanie wzorów cząsteczek , wzory chemiczne
- równania reakcji chemicznych – odczytywanie, współczynniki
- obliczanie zawartości procentowej pierwiastka w związku – zadania
- obliczanie stosunku masowego – zadania
- prawo zachowania masy – zadania
- prawo stałości składu – zadania
- obliczenia stechiometryczne – wykorzystanie masy cząsteczkowej – dzisiejsza lekcja
*
Powtarzajcie , notatki, whiteboard, podręcznik
Powodzenia , powtarzamy na reamsach 🙂
*
07. 04. 2021
Temat: Prawo zachowania masy.
*
Witam Was Dzieci!
*
Lekcja na platformie. Uważam, że dacie sobie z nią radę. To właściwie trochę łatwej matematyki. 🙂
*
Prawo zachowania masy dotyczy reagujących substancji.
Masa substratów użytych do reakcji chemicznej jest zawsze równa masie produktów otrzymanych w wyniku tej reakcji.
*
Obejrzyjcie filmik
*
Temat w podręczniku na stronach 148 – 150
*
Rozwiążemy zadanie z podręcznika
Zadanie 1 / 150
- układamy równanie do zadania, zawsze od tego zaczynamy zadania
- Mg + O2 => MgO
- współczynniki reakcji, liczba atomów poszczególnych pierwiastków przed i po reakcji jest taka sama
- 2 Mg + O2 => 2 MgO
- x 48 g 120 g
- aby obliczyć masę magnezu oczywiście odejmujemy od masy produktu masę substratu
- 120 g – 48 g = 72 g
- Odp. Spaleniu w tlenie uległo 72 g magnezu.
*
Karta pracy z rozwiązanymi zadaniami oraz zadaniami do obliczenia, taka sama podpięta na mobidzienniku.
*
Prawo zachowania masy
Masa substratów użytych do reakcji jest równa masie produktów otrzymanych w wyniku reakcji.
Rozwiązując zadanie – musisz ułożyć równanie reakcji i zbilansować je ( dobrać współczynniki reakcji ).
Zadanie 1.
Przeprowadzono reakcję rozkładu 6,51 g tlenku rtęci (II), w wyniku której powstało 6,03 g rtęci. Oblicz masę tlenu, który powstał w wyniku reakcji?
AgO => Ag + O2
6,51 g 6,03 g x
6,51 = 6,03 + x
x = 6,51 – 6,03
x = 0,48 g
Zadanie 2.
Podczas prażenia wapienia otrzymano 112 g wapna palonego i 88 g tlenku węgla (IV). Ile gramów wapienia poddano prażeniu?
CaCO3 => CaO + CO2
x 112 g 88 g
x = 112 + 88
x = 200 g
Zadanie 3.
W wyniku spalenia 4 g wodoru w chlorze otrzymano 146 g chlorowodoru. Ile gramów chloru użyto do reakcji?
Zadanie 4.
Ile gramów chloru przereagowało z 2,3 g sodu, jeżeli w wyniku reakcji otrzymano 5,85 g chlorku sodu?
Zadanie 5.
Ile gramów siarczku glinu powstanie w wyniku reakcji 5,4 g glinu z 9,6 g siarki?
Zadanie 6.
Wodór o pewnej masie przereagował z tlenem o masie 8 razy większej. Oblicz masę wodoru i masę tlenu, jeżeli w wyniku reakcji powstało 36 g wody ?
2 H2 + O2 => 2 H2O
x 8x 36 g
x + 8x = 36
9x = 36 / : 9
x = 4 g
wodór = 4 g,
tlen = 8 razy 4 g = 32 g
Zadanie 7.
W wyniku reakcji magnezu z tlenem powstało 120 g tlenku magnezu. Oblicz masę wodoru i masę tlenu biorących udział w reakcji, jeżeli masa tlenu stanowiła 2/3 masy magnezu.
*
Zróbcie zadania, omówimy je na teamsach.
Pozdrawiam 🙂
*
31. 03. 2021
Temat: Równania reakcji chemicznych – ćwiczenia.
*
Witam Was Dzieci!
*
Dzisiaj lekcja na platformie.
W dalszym ciągu ćwiczymy pisanie równań reakcji chemicznych.
Prosze – przeanalizujcie moje wyjaśnianie.
Wykonajcie kartę pracy – jest podpięta również w mobidzienniku.
Wysyłam dwoma sposobami
*
*
Równania reakcji chemicznych
Zadanie 1 / 147
a)
chlor + chrom => chlorek chromu (III)
ustalamy wzór cząsteczki na podstawie wartościowości
III I
Cl2 + Cr => CrCl3
pamiętamy, że liczba atomów danego pierwiastka przed i po reakcji musi być taka sama; zwiększamy liczbę cząsteczek chlorku i odpowiednio cząsteczek chloru i atomów chromu
3 Cl2 + 2 Cr => 2 CrCl3
trzy cząsteczki chloru reagują z dwoma atomami chromu w wyniku czego powstają dwie cząsteczki chlorku chromu (III)
b)
żelazo + tlen => tlenek żelaza (II)
II II
Fe + O2 => Fe O
Ustalamy współczynniki czyli bilansujemy reakcję
2 Fe + O2 => 2 FeO
dwa atomy żelaza reagują z jedną cząsteczką tlenu tworząc dwie cząsteczki tlenku żelaza (II)
c)
siarka + sód => siarczek sodu
I II
S + Na => Na2 S
współczynniki
S + 2 Na => Na2S
jeden atom siarki reaguje z dwoma atomami sodu tworząc jedna cząsteczkę siarczku sodu
d)
woda => tlen + wodór
I II
H2O => O2 + H2
Bilansujemy
2 H2O => O2 + 2 H2
dwie cząsteczki wody rozkładają się tworząc jedna cząsteczkę tlenu i dwie cząsteczki wodoru
*
Równania reakcji chemicznych
Zadanie 1.
Dobierz współczynniki stechiometryczne w równaniach reakcji chemicznych
- Cu + O2 => Cu2O
- Al + O2 => Al2O3
- Cu + C => Cu + CO2
- K + Cl2 => KCl
- Cu + NO2 => Cu2O + NO
- Na + Cl2 => NaCl
- N2O3 + H2O => HNO2
- SO2 + O2 => SO3
- Fe + Cl2 => FeCl3
- Pb + O2 => PbO
Zadanie 2.
Dobierz współczynniki stechiometryczne, podaj interpretację słowną
- NO + O2 => NO2
- N2 + O2 => N2O
- K + Br2 => KBr
- Cr + HCl => CrCl3 + H2
- NH3 + O2 => N2 + H2
Zadanie 3.
Uzupełnij równania reakcji, dobierz współczynniki
- ………. + S => Li2S
- K + …….. => K2O
- Ag2O => Ag + ……..
- Na + ……… => NaH
- Mg + ……… => MgO
- PbO + H2 => …….. + H2O
- Fe2O3 + CO => ……… + CO2
- …….. + CuCl2 => Cu + CrCl3
- …….. + ……… => Fe2O3
- P4 + ……… => P4O10
Zadanie 4.
Ułóż i uzgodnij równania reakcji chemicznych
- wodór z tlenem, produktem jest woda
- glinu z siarką, produktem jest siarczek glinu
- sodu z tlenem, produktem jest tlenek sodu
- wapnia z wodorem, produktem jest wodorek wapnia CaH2
- węgla z wodorem, produktem jest metan CH4
- wodoru z chlorem, produktem jest chlorowodór HCl
*
Pozdrawiam 🙂
*
29. 03. 2021
Temat: Równania reakcji chemicznych.
*
Witam Was!
*
Po lekcji na teamsach.
Dzisiaj ćwiczenia – pisanie równań reakcji chemicznych – tym razem zapisywaliśmy reakcje za pomocą symboli i wzorów, już nie słownie.
- przeczytaj – zapoznaj się – z pisaniem reakcji , podręcznik strony 142 – 146
- notatki z teamsów, z whieboarda, pamiętajcie o notatkach
- zadanie 2 / 147
- uzupełniając współczynniki reakcji – duże liczby przed symbolami pierwiastków i wzorami związków chemicznych – zawsze pamiętamy, że liczba atomów danego pierwiastka przed i po reakcji musi być taka sama
- zadanie 5 / 158 – to praca do sprawdzenia na 12 kwietnia
- 31 marca – lekcja na platformie i karta pracy
- 7 kwietnia – lekcja na platformie i karta pracy
- w ramach utrwalenia – obejrzyj filmik
*
Utrwalaj, pisz reakcje. Pozdrawiam 🙂
*
24. 03. 2021
Temat: Zadania – ustalanie wzoru rzeczywistego, stosunki procentowe i masowe.
*
Witam Was!
*
Lekcja na platformie, a tak właściwie karta pracy wysłana przez mobidziennik.
Teraz inny sposób zadanie 3 / 141
- S = 50%
- a więc O = 50%
- SxOy
- x/y = 50/50 = 1 /1
- m at S = 32 u , m at O = 16 u
- x / y razy 32 / 16 = 1 /
- mnożymy przez odwrotność czyli 16/32
- zostaje
- x / y = 16/32
- skracamy przez 16
- x / y = 1 / 2
- indeks x = 1 , y = 2
- wzór tlenku siarki
- SO2
Proszę o wykonanie zadań z karty pracy, do poniedziałku na teamsach, pozdrawiam 🙂
KARTA PRACY
Prawo stałości składu związku chemicznego 24. 03. 2021
Zadanie 1.
Ustal wzór sumaryczny i nazwę związku chemicznego, w którym cynk i chlor są połączone w stosunku 13:14
( inny sposób niż podczas teamsów )
Zn x Cl y
nie znamy liczby atomów, musimy ustalić wzór
Masa at. cynku 65 u
Masa at. chloru 35 u
x/y = 13/14
x/y razy 65/35 = 13/14
mnożymy przez 35/65, aby pozbyć się liczb przy x/y
otrzymamy
x/y = 13/14 razy 35/65
skracamy , jak ułamki zwykłe, 13 i 65 przez 13, 14 i 35 przez 7, i jeszcze 5
otrzymaliśmy
x/y = ½
czyli 1 atom cynku i 2 atomy chloru
wzór ZnCl2 chlorek cynku ( II )
Zadanie 2.
Stosunek masowy żelaza do tlenu w pewnym związku wynosi 7:2. Podaj wzór sumaryczny i nazwę związku.
Zadanie 3.
Oblicz skład procentowy ( procent masowy ) pierwiastków w związkach chemicznych
- tlenek magnezu
- tlenek fosforu ( V )
Zadanie 4.
Ustal wzór związku chemicznego zawierającego 83% potasu i 17% tlenu.
m at. potasu = 39 u
m at. tlenu = 16 u
83 /17 skracamy przez 17, w przybliżeniu to
5 / 1 – stosunek wagowy
x/y = 5 /1
x / y razy 39 / 16 = 5 / 1
mnożymy przez odwrotność, podobnie jak w równaniach
x / y = 5 / 1 razy 16 / 39
otrzymujemy
x / y = 80 / 39
w przybliżeniu
2 / 1
x = 2 atomy potasu, y = 1 atom tlenu
K2O
Zadanie 5.
W pewnym tlenku siarki zawartość procentowa tlenu wynosi 60%. Oblicz stosunek wagowy pierwiastków w tym tlenku oraz podaj wzór sumaryczny ( rzeczywisty).
Zadanie 6.
Ustal wzór rzeczywisty tlenku azotu tlenku azotu o masie cząsteczkowej 108 u, zawierającego 25,9 % azotu.
Wiemy, że m at. azotu = 14 u , m at. tlenu = 16 u
Proporcja, obliczamy udział masowy, masę, azotu
100% – 108 u
25,9 % – x
Obliczamy
x = 28 u
28 u : 14 u = 2 atomy
tlen
108 u – 28 u = 80 u
80 u : 16 u = 5 atomów
Wzór związku N2O5
Zadanie 7.
Ustal wzór rzeczywisty tlenku chloru o masie cząsteczkowej 119 u, wiedząc, że zawiera on 59,66% chloru.
Zadanie 8.
Oblicz stosunek masowy pierwiastków w :
- tlenku miedzi ( I )
- tlenku miedzi ( II )
*
22. 03. 2021
Temat: Prawo stałości składu związku chemicznego – zadania utrwalające.
*
Witam Was!
*
Po lekcji na teamsach.
Powtórzyliśmy, utrwaliliśmy i poznaliście nowe typy zadań.
Podręcznik – zad. 1 – 4 / 141
Whiteboard – w pliku każdego zespołu..
Ćwiczcie, to bardzo ważne zadania.
Karta pracy będzie wysłana na mobidziennik.
W środę – lekcja na platformie.
Pozdrawiam 🙂
*
17. 03. 2021
Temat: Prawo stałości składu związku chemicznego.
*
Witam Was!
*
Dzisiaj lekcja na platformie.
Prawo stałości składu związku chemicznego – ściśle związane z proporcją.
Substancje reagują zawsze w tych samych stosunkach lub stosunek mas substratów jest zawsze stały.
*
Robiliśmy podobne zadania z matematyki, tutaj ścisła korelacja międzyprzedmiotowa.
przykłady:
W każdym związku chemicznym stosunek mas pierwiastków jest stały i jest charakterystyczny dla danego związku.
Obliczamy stosunek masowy pierwiastków w związku chemicznym
- Al2O3
- masy cząsteczkowe Al = 27 u , O = 16 u
- Al : 0
- 2 razy 27 u : 3 razy 16 u
- 54 u : 48 u
- dzielimy przez 6
- 9 : 8
- zawsze do stosunku czyli ułamka, nieskracalnego
- obliczyliśmy stosunek masowy glinu do tlenu w tlenku glinu
*
Obliczamy skład procentowy pierwiastków w związku chemicznym
Wykorzystamy związek Al2O3
- masa cząsteczkowa : 2 razy 27 u + 3 razy 16 u = 54 u + 48 u = 102 u
- obliczamy % Al w związku
- możemy ułożyć proporcję
- 102 u – 100 %
54 u – x %
- x razy 102 u = 54 u razy 100 %
- x = 53 %
- % O :” 100 % – 53 % = 47 %
*
Obejrzyjcie filmik
- przeanalizujcie przykłady z podręcznika ze stron 138 – 139
- wykonajcie w zeszycie zadania 1, 2 / 141 , z podręcznika
*
Na dzisiaj to wszystko, pozdrawiam Was , do poniedziałku na teamsach
*
15. 03. 2021
Temat: Wzory i nazewnictwo – ćwiczenia utrwalające.
*
Witam Was!
Dzisiaj lekcja zdalna.
Na mobidziennik wysłałam Wam częściowo uzupełnioną kartę pracy. Sprawdźcie – prosze, pozostałe ćwiczenia omówimy.
Pozdrawiam Was, 🙂
*
10. 03. 2021
Temat: Ćwiczenia utrwalające – nazewnictwo, wzory sumaryczne i strukturalne, wartościowość.
*
Witam was!
*
Lekcja na platformie, ostatnia godzina powtórzenia lub utrwalenia.
Ćwiczcie zadanai ze strony 136.
Prześlę również dodatkowe materiały do ćwiczeń.
*
Dzieci, karta pracy wysłana przez mobidziennik, oczywiście do zrobienia
Na chwilę obecną to wszystko.
Pozdrawiam was serdecznie 🙂
*
08. 03. 2021
Temat: Wartościowość a wzory chemiczne – ćwiczenia.
*
Witam Was!
*
Po lekcji na teamsach.
Powtarzaliśmy i utrwalaliśmy pisanie wzorów sumarycznych, wzorów strukturalnych, wykorzystanie wartościowości przy ustalaniu wzorów, nazewnictwo związków itp.
Zadania ze strony 136 z podręcznika.
Na dzisiaj to wszystko, dużo do ćwiczenia, pozdrawiam
*
03. 03. 2021
Temat: Wpływ rodzaju wiązania na właściwości związku chemicznego.
*
Witam Was!
Dzisiaj lekcja na platformie.
Proszę jak zawsze o notatkę!
Podsumowanie – i wnioski:
- wiązanie atomowe ( kowalencyjne ) niespolaryzowane – wspólna para elektronowa,
- wiązanie atomowe spolaryzowane – przesunięcie , w dalszym ciągu wspólnej, pary elektronowej w kierunku atomu o wyższej elektroujemności
- wiązanie jonowe – oderwanie elektronu od atomu o niższej elektroujemności, powstają jony – kationy ( z oderwanym elektronem ) i aniony ( z pobranym elektronem ),
- mówimy, że to na ogół przeniesienie elektronu z metalu na niemetal
- związki jonowe – mają wiązania jonowe
- związki kowalencyjne – wiązania kowalencyjne
- budowa : jonowe – wiązania mocne, tworzą sieć krystaliczną
- stan skupienia: jonowe – tylko stały, kowalencyjne – stały, ciekły i gazowy
- temperatura topnienia i wrzenia: jonowe – wysoka, dużo energii do stopienia, kowalencyjna – znacznie niższe temperatury
- rozpuszczalność w wodzie: jonowe – dobrze, kowalencyjne – słabo, kowalencyjne spolaryzowane – dość dobrze
- przewodzenie prądu i elektryczności: jonowe rozpuszczone w wodzie lub stopione – przewodzą, nierozpuszczone – nie przewodzą; kowalencyjne – większość nie przewodzi, są wyjątki
- jeszcze obejrzyjcie filmik
*
Praca domowa: zad. 1, 2 / 129, oczywiście podręcznik 🙂
*
Powtarzajcie, w poniedziałek utrwalamy , pozdrawiam Was serdecznie 😉
*
01. 03. 2021
Temat: Powtórzenie poznanych wiadomości – wiązania i elektroujemność.
*
Po lekcji na teamsach.
*
Powtarzaliśmy poznane wiadomości o wiązaniach chemicznych.
Cała lekcja jest do odtworzenia na teamsach, proszę o notatkę w zeszycie.
Do obejrzenia – powtórnie filmiki!
*
Utrwalajcie i uczcie się. Pozdrawiam
*
Lekcja 24.
24. 02. 2021
Temat: Wiązanie jonowe.
*
Dzień dobry Dzieci!
*
Lekcja na platformie.
Spróbuję najważniejsze rzeczy Wam przedstawić, ale proszę również zajrzeć do podręcznika.
- wiązanie jonowe – różnica elektroujemności – między pierwiastkami tworzącymi wiązanie – co najmniej 1,7
- to na ogół wiązanie między atomami grupy 1 lub 2 oraz atomami grupy 15 – 17
- elektron ( grupa 1 ) lub elektrony – zostają oderwane oderwane; te atomy nie mają elektronów walencyjnych, stają się jonami dodatnimi czyli kationami
- atomy – grupy 15 – 17, zabrały elektrony, oderwały je, dołączyły do siebie, mają nadmiar elektronów , stają się jonami ujemnymi czyli anionami
*
- kation ” tyludodatni ” – ile oddał elektronów
- anion ” tyluujemny ” – ile dołączył elektronów
- Przeczytaj z podręcznika strony : 121 – 123
- Dzieci – tłumaczenie na teamsach, przeczytajcie jeszcze raz ostatnie trzy lekcje, pamiętajcie o notatkach
*
pozdrawiam Was , trzymajcie się zdrowo
*
Lekcja 23.
22. 02. 2021
Temat: Wiązanie kowalencyjne – ćwiczenia utrwalające.
*
Po lekcji na teamsach.
Proszę – czytajcie, analizujcie – rysujcie wiązania. Podręcznik to uzupełnienie lekcji, ale też zaglądajcie do niego.
- elektroujemność – zdolność pierwiastka do przyciągania elektronów – duża wartość, lub oddawania – mała wartość
- wiązanie kowalencyjne – ” klasyczne” – różnica elektroujemności = 0, występuje między takimi samymi atomami w cząsteczce tlenu, wodoru, azotu itp
- wiązanie kowalencyjne spolaryzowane – różnica elektroujemności do wartości 1,7 – para elektronowa,( elektrony różnych pierwiastków tworzą wiązanie ) jest przesunięta w stronę pierwiastka o większej elektroujemności; to wiązanie w cząsteczce wody, dwutlenku węgla
- przesunięcie elektronów w kierunku atomu o wyższej elektroujemności powoduje powstanie bieguna ujemnego, są tutaj nadmiarowe elektrony, jest ich więcej niż dodatnich protonów,
- przy atomie, od którego przesunęły się elektrony powstaje biegun dodatni – protony dodatnie przecież pozostały, brak jest ujemnych elektronów
*
- spróbuj rozrysować cząsteczkę dwutlenku węgla
- na dzisiaj to wszystko, pozdrawiam
*
Lekcja 22.
17. 02. 2021
Temat: Wiązanie kowalencyjne.
*
Dzień dobry Dzieci!
*
Dzisiaj lekcja na platformie.
Zaczynamy omawiać wiązania.
dzisiaj pierwszy rodzaj wiązań – wiązanie kowalencyjne.
Wiązanie tworzy się między atomami, a właściwie między elektronami walencyjnymi pierwiastków. Mogą to być atomy tego pierwiastka, no . w czasteczkach gazów, tlenu, wodoru , jak równiez między atomami różnych pierwiastków.
*
Wasze zadanie na ten tydzień
- przeczytać, przeanalizować z podręcznika strony 110 – 118 ( do drugiego filmiku ) oraz strony 119 – 120 ( do drugiego filmiku )
- obejrzyjcie filmik
*
I jeszcze jeden
*
Na dzisiaj to wszystko, czytajcie, oglądajcie – na teamsach wszystko wyjaśniam ! Pozdrawiam serdecznie
*
Lekcja 21.
15. 02. 2021
Temat: Pisanie wzorów i nazw związków chemicznych – ćwiczenia.
*
Dzień dobry Dzieci!
*
Po lekcji na teamsach.
*
Dzisiaj ćwiczenia :
- nazewnictwo związków chemicznych,
- określanie liczby atomów lub cząsteczek,
- określanie liczby atomów pierwiastków w cząsteczce,
- pisanie wzorów sumarycznych związków chemicznych na podstawie wartościowości
- zadania 1 – 6 / 136
- jeszcze raz filmiki z pistacji, cały czas ćwiczymy
*
Na dzisiaj to wszystko, pozdrawiam
*
Lekcja 20.
10. 02. 2021
Temat: Wartościowość. Ustalanie wzorów i nazw związków chemicznych.
*
Dzień dobry Dzieci!
*
Dzisiaj lekcja na platformie.
Dość trudna do tłumaczenia podczas nauki zdalnej.
Obejrzyjcie filmiki, przeanalizujcie treści z podręcznika, w poniedziałek na teamsach pełne tłumaczenie.
*
- Podręcznik – strony 130 – 136, głównie przykłady – to na końcu lekcji
- wartościowość – to zdolność danego pierwiastka do utworzenia wiązania
- obejrzyjcie filmiki
Jeszcze jeden
*
Trochę gorszy
*
Wzory sumaryczne – pokazują ile i jakich atomów buduje cząsteczkę oraz wzory strukturalne – pokazują jej budowę
*
- Ustalanie czyli pisanie wzorów na podstawie wartościowości. Wszystko zawsze z układem okresowym.
- obejrzyjcie filmiki
Jeszcze jeden
*
Też chyba trochę gorszy ?
*
- przypominam o podręczniku*
- do usłyszenia
- *
Lekcja 19.
08. 02. 2021
Temat: Sprawdzian: ” Atom i cząsteczka”.
*
Lekcja 18.
03. 02. 2021
Temat: Odczytywanie symboli i wzorów chemicznych.
*
Dzień dobry Dzieci!
*
Dzisiaj lekcja na platformie.
Nowa lekcja, właściwie utrwalenie już znanych wiadomości oraz małe powtórzenie przed sprawdzianem.
*
Atom co coś pojedynczego, oznaczamy go symbolem.
- h atom wodoru
- 3 H trzy atomy wodoru
- H2, gdzie 2 w prawym dolnym rogu – to już cząsteczka wodoru
- obejrzyjcie filmik
*
W podręczniku – strona 112 oraz 132.
*
Kol
Nie ten filmik , sorki
*
Może ten
*
Jeszcze jeden
*
I jeszcze zadania z podręcznika. mam nadzieję, że je zrobiliście
*zad. 3 / 108:
- N2 = 2 x 14 u = 28 u ; to krzem Si
- 2 x 28 u = 56 u ; to żelazo Fe
- 28 u : 4 = 7 u ; to lit Li
*zad. 4 / 108
- 54 u : 2 = 27 u ; to Al , glin
- 48 u : 3 = 16 u ; to O , tlen
- wzór Al2O3
*zad. 5 / 108
- EO2 = 64 u , 2xO = 2 x 16 u = 32 u ; 64 u – 32 u = 12 u , to węgiel C
- CO2
- K2EO4 = 174 u , 2 x K = 2 x 39 u = 78 u , 4 x O = 4 x 16 u = 64 u , 174 u – 78 u – 48 u = 32 u , to jest siarka S
- K2SO4
- H2E2O7 = 178 u , 2 x H = 2 x1 u = 2, 7 x O = 7 x 16 u = 112 u , 178 u – 2 u – 112 u = 64 u ; 64 u : 2 = 32 u , to siarka S
- H2S2O7
*
To na dzisiaj wszystko, pozdrawiam
*
Lekcja 17.
01. 02. 2021
Temat: Powtórzenie wiadomości o atomach i cząsteczkach.
*
Dzień dobry Dzieci!
*
po lekcji na teamsach.
Za tydzień spraw dzian.
Dzisiaj powtórzenie. Robiliśmy zadania z podręcznika ze strony 105 oraz 108.
I według tych punktów proszę przygotujcie się.
Pozdrawiam
Lekcja 16.
27. 01. 2021
Temat: Zależność między budową pierwiastka chemicznego a jego położeniem w układzie okresowym.
*
Dzień dobry Dzieci!
*
- Dzisiaj – PRACA Z PODRĘCZNIKIEM !
- Dzisiaj lekcja na platformie. Wszystko, co macie dzisiaj poznać, już zostało wcześniej omówione.
- Zacznijcie proszę od waszego podręcznika strona 100 – Przeczytaj – zrozumiesz!
- Wszystko, co tam opisano – już omawialiśmy!
- następnie tabela 10
- przykłady strony 102 – 103.
- zmiana aktywności w układzie – o tym tez już mówiliśmy – z tego również notatka
- praca domowa – zad. 1, 2 / 105
- na teamsach – wszystko jeszcze raz powtórzymy
- do sprawdzianu – według powtórzenia na stronie 106 – 107 – teoria
- do powtórzenia – do sprawdzianu – będziemy robić zadania ze strony 108; możecie powtórzyć na poniedziałek – będziemy omawiać !
- i do obejrzenia – jako dzisiejsza lekcja – filmik
*
Czytajcie uważnie, róbcie notatki w zeszycie – na pewno dacie radę ! Do usłyszenia na teamsach!
*
Lekcja 15.
25. 01. 2021.
Temat: Układ okresowy pierwiastków chemicznych.
*
Dzień dobry Dzieci!
*
Lekcja na teamsach, tutaj jedynie podsumowanie.
Pamiętajcie o notatce:
- każdy pierwiastek chemiczny ma swoje miejsce w układzie okresowym
- pierwiastki ułożone są w układzie według wzrastającej liczby atomowej
- w układzie okresowym możemy wyróżnić: okresy – jest ich 7 – to poziome wiersze, oraz grupy – jest ich 18 – to pionowe kolumny
- okresy zaczynają się aktywnym metalem, kończą gazem szlachetnym, nieaktywnym
- prawo okresowości – właściwości pierwiastków chemicznych, uporządkowanych zgodnie ze wzrastającą liczbą atomową, powtarzają się okresowo
- grupy główne : 1, 2 oraz od 13 do 18
- grupy poboczne : od 3 do 12
- nazwy grup głównych tworzymy od pierwszego pierwiastka w grupie – wypisz nazwy grup głównych
- twórca układu okresowego – Dmitrij Mendelejew – notatka, kilka zdań
- i w ramach powtórzenia – obejrzyjcie filmik, teraz już na pewno zapamiętacie
*
Na dzisiaj to wszystko, następna lekcja na platformie. Pozdrawiam Was serdecznie
*
Lekcja 14.
20. 01. 2021
Temat: Izotopy.
*
Dzień dobry Dzieci!
Dzisiaj lekcja na platformie zdalnej.
Troszkę więcej waszej pracy. Jednocześnie – dzisiaj z wiadomością na mobi o lekcji, wyślę Wam kartę pracy. To do ćwiczenia, nic mi nie odsyłacie. Sprawdzimy sobie w poniedziałek na teamsach.
W zeszycie oczywiście notatka.
*
Mówimy o izotopach danego pierwiastka. Mają one taką samą liczbę atomową, czyli tyle samo protonów ( i elektronów ), różnią się liczbą masową czyli liczbą neutronów.
*
Najbardziej charakterystyczne są izotopy wodoru.
- H prot, 1 e, 1 p , 0 n
- D deuter 1 e, 1 p, 1 n ( służył w czasie II wojny do produkcji tzw, ciężkiej wody )
- T tryt, 1 e, 1 p, 2 n
*
Ważna rzecz – definicja jednostki masy atomowej – to 1 / 12 masy atomu izotopu węgla, gdzie dla węgla Z = 6, A = 12.
*
Obejrzyjcie krótki filmik
*
I jeszcze jedna rzecz, ważna. Średnia masa atomowa. Najpierw filmik
*
Na podstawie filmiku i podręcznika , str. 92, napiszcie w zeszycie definicje średniej masy atomowej.
- Spróbujcie zrobić w zeszycie zadania 2, 3, 4 z podręcznika , strona 94
- I oczywiście – najważniejsza dla nas informacja – Maria Skłodowska-Curie, w zeszycie chociaż kilka zdań – jakie badania prowadziła, co odkryła.
*
To wszystko, do usłyszenia na teamsach, pozdrawiam Was serdecznie.
*
Lekcja 13.
18. 01. 2021.
Temat: Budowa atomu – ćwiczenia utrwalające.
*
Dzień dobry w nowym roku!
Wracamy do zdalnej szkoły. Na teamsach przypomnimy sobie ostatnia lekcję, i oczywiście wytłumaczymy kolejne ćwiczenia.
W zeszycie , tak jak zawsze, notatka. 🙂
*
- Rozmieszczenie elektronów w atomie
Każda z powłok ma ściśle określoną możliwość upakowania na niej elektronów. Mamy 7 powłok, to jednocześnie okresy, w układzie okresowym to wiersze, poziomo.
K 2 e
L 8 e
M 18 e / lub 8 e
N 32 e / lub 18 e
O 18 e / 32 e
P 18 e
Q ( pozostałe )
2. Uproszczony model budowy atomu
Pokazuje rozmieszczenie elektronów na powłokach
3. Powłoka walencyjna i elektrony walencyjne
Jest to powłoka najbardziej oddalona od jadra atomowego. Elektrony, które na niej się znajdują to elektrony walencyjne. I to one biorą udział w tworzeniu wiązań z innymi atomami czyli biorą bezpośredni udział w tworzeniu wiązań chemicznych.
4. Budowa atomu
(z lekcji poprzedniej ) – protony i neutrony – wchodzą w skład jądra atomowego – to wspólna nazwa nukleony. Wokół jądra krążą – na powłokach – elektrony.
5. Liczba atomowa i liczba masowa – to również poprzednia lekcja.
7. Na lekcji pracujemy według strony 90 z podręcznika.
Ćwiczenia, których nie wykonamy to praca domowa.
*
Lekcja 12.
21. 12. 2020
Temat: Budowa atomu – nukleony i elektrony.
*
Dzień dobry Dzieci!
*
Dzisiaj lekcja na teamsach. Platforma uzupełnia Waszą wiedzę. Będziemy rozmawiać o budowie atomu.
Poznacie:
- z jakich cząstek elementarnych zbudowany jest atom,
- co to jest rdzeń atomowy
- powłoki elektronowe i elektrony walencyjne
- co to jest liczba atomowa
- co to jest liczba masowa
*
Proszę obejrzyjcie filmik
*
Wszystko wyjaśnimy podczas zajęć na teamsach. Pozdrawiam
*
Lekcja 11.
16. 12. 2020
Temat: Masa atomowa i masa cząsteczkowa.
*
Dzień dobry Dzieci!
*
Dzisiaj lekcja na platformie. Proszę wykonajcie notatkę według punktów i ćwiczenia.
*
Otwórzcie układ okresowy pierwiastków na końcu książki. Taki, gdzie podział na metale i niemetale.
Pod symbolem pierwiastka jest podana jego masa atomowa. Liczba, która jest ułamkiem musi być zaokrąglona do liczby naturalnej, według wszystkich zasad zaokrąglania.
Masę atomowa podajemy w jednostkach u.
Podam kilka przykładów:
- m at C = 12 u
- m at O = 16 u
- m at H = 1 u
Te trzy masy musicie znać na pamięć !
- m at Mg = 24 u
- m at Al = 27 u
- m at Ci = 35,5 u – to jedyna masa atomowa, która jest wyrażona ułamkiem !!
*
Masa cząsteczkowa to masa cząsteczki pierwiastka lub związku chemicznego, wyrażona w atomowych jednostkach masy u.
Obliczamy ja dodając masy atomowe wszystkich atomów pierwiastków tworzących daną cząsteczkę.
- masa cząsteczki azotu : 2 x 14 u = 28 u
- masa cząsteczki amoniaku NH3 = 1 x 14 u + 3 x 1 u = 17 u
- masa tlenku potasu K2O = 2 x 39 u + 1 x 16 u = 94 u
*
Mam nadzieję, że wszystko rozumiecie. w razie czego filmik, obejrzyjcie proszę
*
I jeszcze zadania ze strony 83 z podręcznika
- zad. 4 / 83
Masa cząsteczkowa związku = 106 u
W cząsteczce jest jeden atom C o masie atomowej 12 u oraz trzy atomy O każdy o masie 16 u.
łącznie : 1 x 12 u + 3 x 16 u = 60 u
Odejmujemy znane masy od masy cząsteczkowej:
106 u – 60 u = 46 u
Ponieważ w cząsteczce są dwa atomy nieznanego pierwiastka to dzielimy na dwa 46 u : 2 = 23 u
Ten pierwiastek musimy odszukać w układzie, jest to sód.
*
Praca domowa , z podręcznika , wykonajcie ją w zeszycie
- zad. 1, 2 / 83
- zad. 3, 5 / 83
*
Lekcja 10.
14. 12. 2020.
Temat: Atomy i cząsteczki – składniki materii.
*
Dzisiaj lekcja na teamsach.
Spróbujemy dzisiaj poukładać sobie nowe pojęcia.
*
- dyfuzja – samorzutne rozprzestrzenianie się jednej substancji w drugiej, najszybciej zachodzi w gazach, najwolniej w ciałach stałych
- czy czujemy zapach wody toaletowej albo perfum, gdy jakaś osoba wejdzie do pomieszczenia, w którym jesteśmy? czy od razu czujemy zapach?
- John Dalton(1803) – teoria atomistyczno-cząsteczkowa budowy materii !! Ważne / założenia teorii również jako notatka
- Czy atomy są duże?
- Masy atomów wyrażamy w atomowych jednostkach masy u
- 1 u = 1/12 masy atomu węgla
- 1 u = 0,166 x 10 do potęgi -23 g
- 1 g = 6,02 x 10 do potęgi 23 u
- atom to „coś” pojedynczego
- cząsteczka to połączenie co najmniej dwóch atomów; mogą to być atomy tego samego pierwiastka , wtedy mówimy o cząsteczkach gazów ( tlen, wodór, azot, chlor) lub atomy różnych pierwiastków – wtedy są to cząsteczki związków chemicznych
*
I jeszcze filmik
*
Wszystko omówimy na lekcji, pozdrawiam
*
Lekcja 9.
09. 12. 2020
Temat: Tlenki – wzory, reakcje otrzymywania. Omówienie wyników testu.
*
Dzisiaj lekcja powtórzeniowa, do poprzedniego działu. Dzisiaj poznajecie wartościowość. Na filmikach to znak rzymski pisany nad symbolem pierwiastka.
Właśnie – symbole pierwiastków – zaliczaliście, proszę sobie przypomnieć.
Na początek – wzory związków chemicznych
Tlenki to połączenia chemiczne ( związki chemiczne) tlenu z innymi pierwiastkami. Dobrze znanymi Wam tlenkami są tlenek wodoru ( woda) i dwutlenek węgla :
H2O– tlenek wodoru , monotlenek diwodoru , woda
CO2 – tlenek węgla (IV) , ditlenek monowęgla, dwutlenek węgla
Wodorki to związki chemiczne wodoru z innymi pierwiastkami; znacie np. : siarkowodór ( H2S) , amoniak ( NH3)
We wzorach tlenków, czy wodorków , tlen jest na drugim miejscu we wzorze. Na pierwszym pierwiastek główny. Tlen, w związkach ma wartościowość II – drugą; wodór I – pierwszą. Wartościowość to zdolność utworzenia wiązania, zdolność „złapania” innego pierwiastka. Wartościowość II – to po prostu dwie rączki, które ma tlen, łapie dwa atomy.
*
Jeszcze jeden filmik, informacyjnie
*
Te filmiki potraktujcie informacyjnie, szczególnie ten drugi!
Nie uczcie się wartościowości. Symbole perfekt, na poniedziałek na teamsach proszę o otwarty układ okresowy pierwiastków.
Notatka krótka, wzory tlenków, jak je tworzymy, proste reakcje, te , które były zapisywane słownie – z filmiku z pistacji – proszę zapisać symbolami.
*
Zaczynamy nowy dział, i o pewnych rzeczach musicie mieć pojęcie.
*
To wszystko na dzisiaj, pozdrawiam , dużo siły i zdrówka!
*
Lekcja 8.
07. 12. 2020
Temat: Test – Składniki powietrza i rodzaje przemian, jakim ulegają.
*
Lekcja 7.
02. 12. 2020
Temat: Podsumowanie wiadomości o składnikach powietrza i rodzajach przemian , jakim ulegają.
*
Dzień dobry Dzieci!
Dzisiaj małe powtórzenie, zwróćcie uwagę powtarzając wiadomości na sprawdzian, na zagadnienia, które przedstawiam poniżej:
- skład powietrza
- obliczanie ilości poszczególnych składników powietrza, które znajdują się w określonym pomieszczeniu
- co to jest powietrze
- właściwości poznanych gazów: tlenu, wodoru, dwutlenku węgla
- otrzymywanie poznanych gazów – z lekcji, filmików
- reakcje charakterystyczne dla poznanych gazów – identyfikacja tych gazów
- zastosowanie oraz wykorzystanie poznanych gazów
- typy reakcji chemicznych, zapis słowny
- reakcje egzoenergetyczne i endoenergetyczne ( termiczne )
- ozon , obejrzyjcie filmik
- gazy szlachetne, podstawowe wiadomości, filmik
- pojęcia: spalanie, palność, higroskopijność, korozja
- skutki zanieczyszczeń powietrza
W razie pytań, wątpliwości – pytajcie, piszcie.
*
Sprawdzian jako plik ukaże się rano w poniedziałek na teamsach. Nie otwieracie, nie klikacie – czyli nic z nim nie robicie. Dopiero, gdy wyraźnie sobie powiemy podczas lekcji !
*
Pozdrawiam, dużo siły i zdrówka 🙂
*
Lekcja 6.
30. 11. 2020
Temat: Rodzaje reakcji chemicznych.
*
Dzień dobry Dzieci!
Po lekcji na teamsach.
Dzisiaj rozmawialiśmy o skutkach zanieczyszczeń. Świat wokół nas jest dla nas bardzo ważny.
*
Dzisiejszy temat to rodzaje reakcji chemicznych.
Trzy typy reakcji:
- syntezy
- analizy
- wymiany
*
Obejrzyjcie proszę filmik, podczas lekcji przykłady.
*
Proszę o zapamiętanie podstawowych pojęć.
Dalsze ustalenia po lekcji. 🙂


I jeszcze jedna grafika
Lekcja 5.
25. 11. 2020
Temat: Zanieczyszczenia powietrza.
*
Dzień dobry Dzieci!
Dzisiaj szczególnie nam bliskie. Musimy przecież zwracać uwagę na nasze środowisko.
Kilka filmików, proszę obejrzyjcie,
*
Proszę o notatkę w zeszycie 🙂
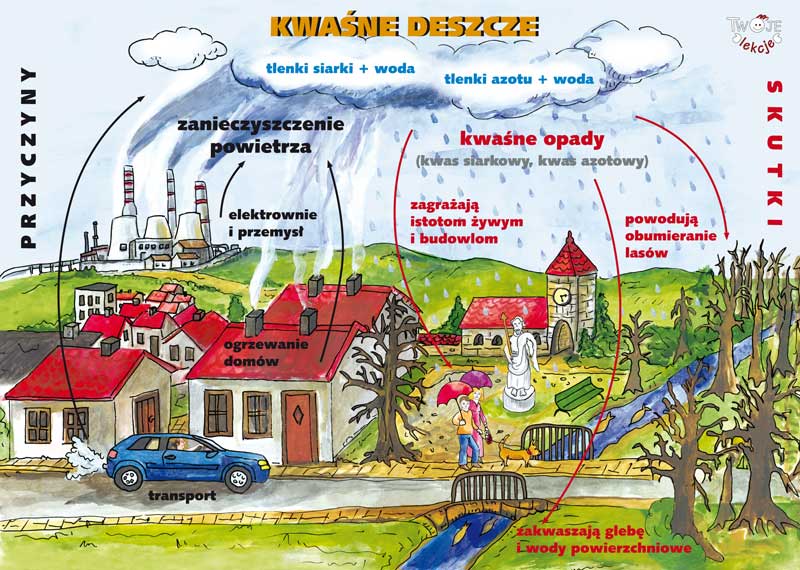
I.Przyczyny zanieczyszczeń powietrza:
a.naturalne : np.wybuchy wulkanów, wyładowania atmosferyczne, pożary
b.antropogeniczne ( wynikające z działalności człowieka ): np. wynikające z produkcji paliw, farb lakierów, nawozów; spalania ( fabryki i gospodarstwa domowe); katastrof w zakładach przemysłowych i transporcie.
II. Skutki zanieczyszczeń :
a. efekt cieplarniany
b. dziura ozonowa
c. kwaśne opady
d. smog
e. obumieranie fauny i flory
f. choroby dróg oddechowych, mutacje , nowotwory, choroby genetyczne.
*
Obejrzyjcie proszę film:
III. Rodzaje zanieczyszczeń powietrza :
- stałe
- ciekłe
- gazowe
*
Praca domowa
- ( tutaj w ramach dalszej części notatki ) proszę wymienić stałe , ciekłe i gazowe zanieczyszczenia powietrza.
- proszę dokładnie, ale krótko, wyjaśnić pojęcia: dziura ozonowa, kwaśny deszcz, efekt cieplarniany ( wystarczą treści z podręcznika )
*
Do usłyszenia na teamsach, dalej będziemy rozmawiać o zanieczyszczeniach powietrza, a właściwie jak przeciwdziałać zanieczyszczeniom.
Pozdrawiam Was serdecznie, dużo zdrówka
*
Lekcja 4.
23. 11 .2020
Temat: Wodór – jego właściwości i zastosowanie.
*
Dzień dobry Dzieci!
*
Dzisiaj lekcja na teamsach, lekcja na platformie pomoże Wam utrwalić wiadomości dotyczące wodoru.
Zaczniemy od filmików. Obejrzyjcie proszę. Pamiętajcie , że każdy filmik możecie obejrzeć kilka razy 🙂
I proszę oglądajcie dalej 🙂
I trochę więcej treści
*
I jeszcze trochę historii
Wodór po raz pierwszy otrzymano sztucznie na początku XVI wieku w reakcji metalu z kwasem. W latach 1766–81 Henry Cavendish stwierdził, że wodór jest oddzielną substancją chemiczną, po spaleniu której powstaje woda. Właściwość ta zadecydowała o nazwie tego pierwiastka chemicznego, bowiem w języku greckim υδρογόνο (ydrogóno) oznacza „tworzący wodę„
Proszę, wykonajcie w zeszycie notatkę, wykorzystując obejrzane materiały, krótkie informacje oraz podręcznik.
- Kto po raz pierwszy otrzymał wodór ?
- Wymień właściwości wodoru.
- Związki, jakie tworzy wodór
- Zastosowanie wodoru
- Co to jest mieszanina piorunująca ?
- Wykonaj w zeszycie zadanie 2 / 65 z podręcznika
*
Wątpliwości zawsze możemy wyjaśnić na teamsach.
Pozdrawiam 🙂
*
Lekcja 3.
18. 11. 2020.
Temat: Dwutlenek węgla i jego właściwości.
*
Dzień dobry Dzieci!
Dzisiejsza lekcja przybliży Wam właściwości, reakcję charakterystyczną oraz reakcje – przemiany, związane z dwutlenkiem węgla.
*
Druga część lekcji – to powtórzenie zajęć z poniedziałku, z lekcji 2. To obejrzyjcie po przerwie, nie oglądajcie wszystkiego od razu.
*
Lekcję odtwarzacie dowolnie – liczbowo i czasowo.
Najważniejsze!!!
Nigdy, sami, bez opieki osób dorosłych – nie przeprowadzacie żadnych doświadczeń chemicznych !!1 Pamiętacie nasze BHP. To jak podczas lekcji. Sami nic nie działacie.
Po obejrzeniu filmów oraz przy pomocy podręcznika – proszę o wykonanie notatki w zeszycie według punktów:
- właściwości dwutlenku węgla
- reakcja charakterystyczna dla dwutlenku węgla
- otrzymywanie dwutlenku węgla
- znaczenie dwutlenku węgla
- wykorzystanie dwutlenku węgla
- co to jest suchy lód ?
- na czym polega obieg węgla w przyrodzie
*
Zaczynamy 🙂
Właściwości przedstawione w trochę inny sposób, a jednocześnie udowodnienie, że w każdych warunkach możemy otrzymać dwutlenek węgla.
Trochę śmieszne…
*
To teraz reakcja charakterystyczna. Oglądajcie 🙂
Mam nadzieję, że wszystko rozumiecie. Chemia jest nauką doświadczalne – wtedy wszystko jest jasne 🙂
*
Teraz trochę śmieszniej. Oglądajcie, tutaj pracują inne zmysły, więcej zapamiętacie.
Już teraz każdy z Was na pewno wie dużo o dwutlenku węgla.
Wiemy, gdzie występuje dwutlenek węgla, skąd pochodzi ( procesy spalania i oddychania), jaką pełni rolę w środowisku( fotosynteza) i jakie stanowi zagrożenia ( gaz cieplarniany). Bardzo ważnym pojęciem ,związanym z CO2 jest tzw. obieg węgla w przyrodzie – biologiczne, chemiczne i fizyczne procesy zachodzące na Ziemi, w wyniku których następuje ciągła wymiana węgla jako pierwiastka znajdującego się w atmosferze, w wodzie, organizmach żywych, ich szczątkach oraz w skorupie ziemskiej.
*
Kilka filmików, które pomogą Wam w powtórzeniu wiadomości o reakcjach z tlenem. Szczególną uwagę zwróćcie na typy reakcji chemicznych. Tu pojawia się ustalanie współczynników reakcji chemicznej.
*
Zaczynamy drugą część lekcji 🙂
Jeszcze jeden – reakcje z tlenem
*
I jeszcze jeden filmik. Uczymy się zapisywać równania reakcji chemiczne. To tylko informacyjnie, porozmawiamy w poniedziałek.
Proszę, obejrzyjcie :
*
Opracujcie lekcję do poniedziałku, będziemy pracować dalej.
Pozdrawiam Was serdecznie, do usłyszenia 🙂
Elżbieta Kolczyńska
*
Lekcja 2.
16. 11.2020
Temat: Tlen – otrzymywanie, reakcja charakterystyczna, reakcje z tlenem.
Witam Was Dzieci!
Dawno się nie widzieliśmy i nie rozmawialiśmy. Dzisiaj lekcja na teamsach i na platformie pracy zdalnej. Oglądajcie powolutku, na teamsach porozmawiamy 🙂
Kto odkrył tlen ?? CIEKAWOSTKI
Pierwszym odkrywcą tlenu najprawdopodobniej był żyjący w XVI wieku na dworze Zygmunta III Wazy alchemik Michał Sędziwój.
Tlen został odkryty ponownie przez Carla Sheele przed rokiem 1773, ale odkrycie nie zostało opublikowane do roku 1777. W tym czasie za odkrywcę tlenu od dwóch lat uznawany był Joseph Priestley, który otrzymał tlen ogrzewając tlenek rtęci(II) i zbierając wydzielający się gaz.
Łacińska nazwa tlenu oxygenium (z gr. oksy – kwaśny, gennao – rodzę), wprowadzona została przez Antoine Lavoisiera.
Polska nazwa „tlen” wywodzi się od słowa „tlić” i została nadana przez Jana Oczapowskiego. Wcześniejsza polska nazwa „kwasoród” była dosłownym tłumaczeniem łacińskiej, a wprowadził ją Jędrzej Śniadecki.
Tlen można otrzymać: * podczas termicznego rozkładu manganianu(VII) potasu, * rozkładu wody utlenionej (w obecności katalizatora)* lub podczas rozkładu wody pod działaniem prądu elektrycznego (elektrolizy wody). Przemysłowa metoda otrzymywania tlenu polega na destylacji ciekłego powietrza. zobacz – skopiuj link : https://nowahistoria.interia.pl/kartka-z-kalendarza/news-5-kwietnia-1883-r-karol-olszewski-i-zygmunt-wroblewski-skrop,nId,1709770
Reakcja charakterystyczna to sposób na 100% rozpoznanie substancji – tylko dana substancja zachowuje się podczas reakcji w ten sposób i dzięki takiej reakcji możemy identyfikować różne pierwiastki i związki chemiczne.
Dzisiaj poznamy reakcję charakterystyczna dla tlenu.
Obejrzyjcie:
podsumowanie: Reakcja charakterystyczna tlenu polega na rozpaleniu żarzącego się łuczywka pod jego wpływem.
Reakcja chemiczna to proces, w którym następuje przemiana substancji i powstają nowe o zupełnie innych własnościach fizycznych i chemicznych .
Obejrzeliście spalanie w tlenie. Omówimy niezrozumiałe dla Was rzeczy na teamsach.
Pierwiastki : magnez, siarka i węgiel łączą się z tlenem i powstają tlenki tych pierwiastków:
Magnez + tlen = tlenek magnezu
siarka + tlen = tlenek siarki (IV)
węgiel + tlen = tlenek węgla (IV)
Reakcja, w której 2 lub więcej pierwiastków łączą się ze sobą dając nowy związek chemiczny nazywana jest reakcją łączenia lub syntezy chemicznej; substancje, które biorą udział w reakcji ( reagują ) to substraty; substancje , które powstają to produkty; substraty i produkty nazywamy łącznie reagentami.
Reakcja syntezy , w której pierwiastki łączą się z tlenem to reakcja utleniania.
Reakcja utleniania , w której reagenty wydzielają światło i ciepło to reakcja spalania.
Reakcja, w której do otoczenia wydzielana jest energia ( ciepło) to reakcja egzoenergetyczna.
Reakcja, w której substraty wymagają energii(np. podgrzania ) aby zaczęły reagować to reakcja endoenergetyczna.
Reakcją odwrotną do reakcji syntezy jest reakcja analizy czyli rozkładu, np.:
tlenek rtęci = rtęć + tlen substrat to tlenek rtęci, produkty to tlen i rtęć.
Trzymajcie się ciepło, porozmawiamy na teamsach. Do usłyszenia.
Elżbieta Kolczyńska
*
Lekcja 1.
28. 10. 2020
Temat: Tlen – najważniejszy składnik powietrza.
Dzień dobry Dzieci!
Po lekcji na teamsach. Dzisiaj omawialiśmy ten najwazniejszy dla człowieka gaz.
Proszę, aby osoby, które nie były na lekcji na teamsach zrobiły w zeszycie notatkę według podanych niżej punktów. Proszę do tego wykorzystać podręcznik i własną wiedzę.
- Właściwości fizyczne i chemiczne tlenu.
- Znaczenie tlenu w przyrodzie.
- Zastosowanie tlenu.
Powodzenia 🙂
Pozdrawiam serdecznie
Elżbieta Kolczynska