Lekcja z dn. 12 maja.2021r.
Temat: Stężenie procentowe roztworu.
Na ostatniej lekcji zapoznaliście się z pojęciem rozpuszczalności, czyli wielkością, która określa liczbę gramów danej substancji rozpuszczonej w danej temperaturze zawsze w 100g wody tak, że powstaje roztwór nasycony; wielkość ta służy do porównywania zdolności różnych substancji do tworzenia roztworów.
Pytanie kluczowe do dzisiejszej lekcji brzmi – jak inaczej wyrazić ilość substancji w roztworze, jeśli roztwór nie jest nasycony ??
W tym celu przyjęto nową wielkość fizyczną
( chemiczną), która wyraża, jaki % całego roztworu stanowi substancja rozpuszczona ; wielkość tą nazywamy stężeniem procentowym roztworu.
obliczamy ją tak jak w matematyce -np. jaki % liczby 10 stanowi liczba 2 ?? ( zamiana ułamków na procenty):
2 z 10 to 2/10 . 100% =20%
żeby usprawnić obliczenia, w chemii wprowadzamy wzór:

- Cp – to stężenie procentowe
- ms- to liczba gramów substancji rozpuszczonej
- mr- to liczba gramów całego roztworu
Jeżeli powiemy , że np. roztwór soli ma stężenie 5% , to znaczy ,że w 100 gramach roztworu znajduje się 5 gramów soli ;95 g stanowi woda( lub inny rozpuszczalnik)- tu widać różnicę między rozpuszczalnością X a stężeniem procentowym Cp.
mr= ms+mrozp. (rozpuszczalnikiem najczęściej jest woda)
a więc: mr = ms+ mH2O
W jakim celu wykorzystujemy stężenie procentowe ?
np. do sporządzania lekarstw( woda utleniona to 3% roztwór nadtlenku wodoru w wodzie, jodyna to 3% roztwór jodu w alkoholu, ocet spożywczy to 10% roztwór kwasu octowego w alkoholu, zalewa do konserwowania owoców , kiszenia ogórków – wg przepisu- to kikuprocentowe roztworu octu cukru, soli, itp); jeżeli mamy nawet duże ilości do sporządzenia , to łatwo jest przeliczać potrzebne masy składników ( nawet w tonach).

Oblicz stężenie procentowe roztworu , sporządzonego z 300 g wody i 100 g cukru .
Dane:
ms=100g
mr= ms+mwody =100g+300g=400g
Cp =?
piszemy wzór:

po podstawieniu mamy :
Cp= 100g/400g . 100% =25%
Odp. Stężenie tego roztworu wynosi 25%
Inne przykłady w załączonym filmiku- popatrzcie i spróbujcie śledzić rozwiązania- można rozwiązywać z proporcji (!); już na następnej lekcji online będziemy rozwiązywać podobne 🙂
To wszystko na dziś – NIC nie odsyłacie , notatka w zeszycie to temat, wzory i przykładowe zadanie .
Więcej przykładów znajdziecie w podręczniku.
Lekcja z dn. 7 maja 2021r.
Temat. Rozpuszczalność substancji w wodzie – ćwiczenia- lekcja online MTeams.
Lekcja z dn. 5 maja 2021r.
Temat; Rozpuszczalność substancji w wodzie.
w dniu 7 maja (piątek) – ćwiczenia z zeszytu ćwiczeń, proszę pobrać i mieć przygotowane na lekcji.
1.Wiemy już, że różne substancje rozpuszczają się w wodzie – lepiej lub gorzej – ale to pojęcie jest mało konkretne, więc :

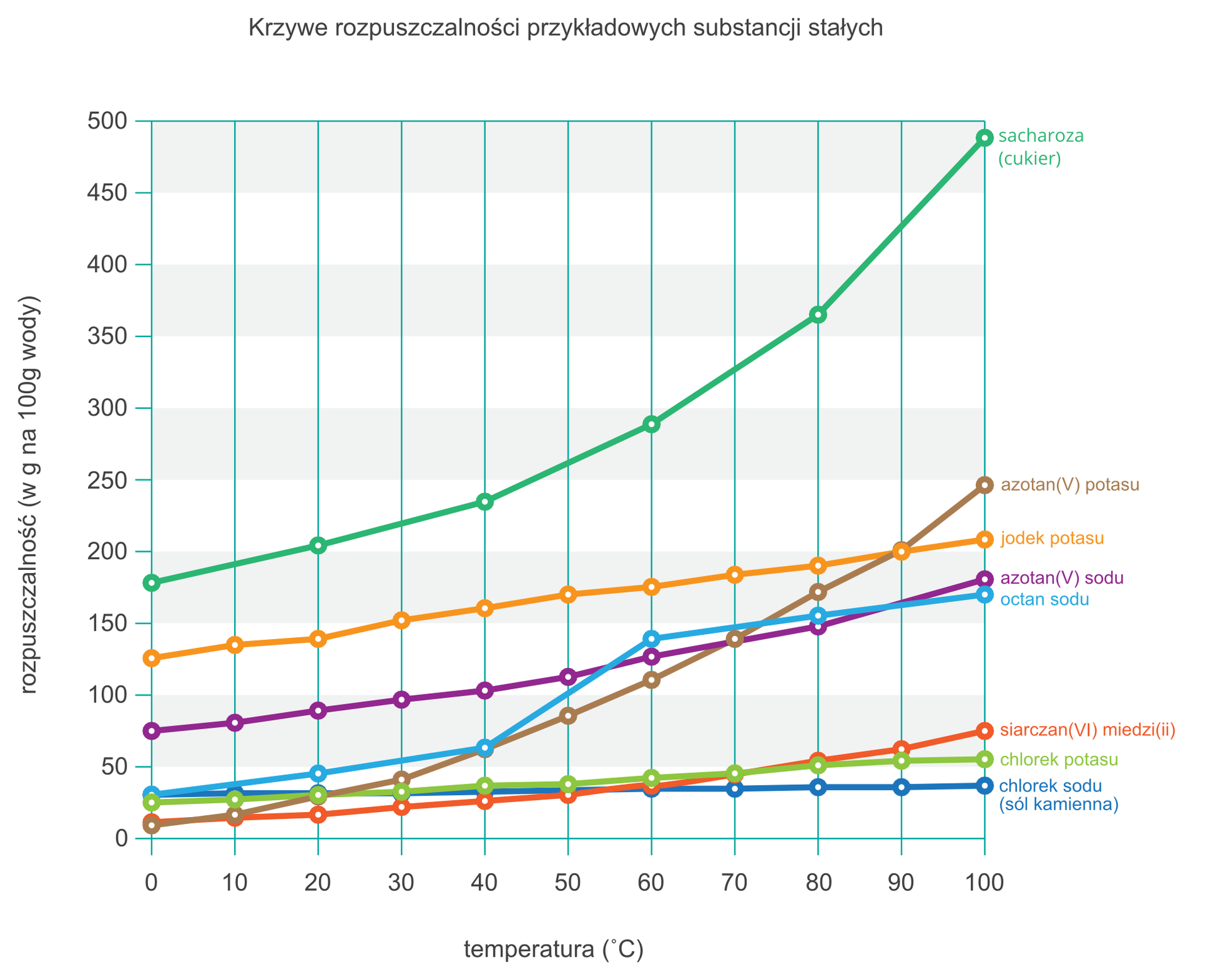
Aby porównywać rozpuszczalność różnych substancji, utworzono tzw. wykresy rozpuszczalności – otwórzcie książkę na stronie178-179.-przeanalizujcie rozpuszczalność ciał stałych i gazów , zwróćcie uwagę ,że np. cukier jest b.dobrze rozpuszczalny w wodzie – już w temeraturze 0 stopni Celsjusza w 100 gramach wody może rozpuścić się około 180 g cukru! , natomiast gazy rozpuszczają sie słabiej w miarę wzrostu temperatury.Odczytywanie wykresu – tak jak odczytywanie współrzędnych z matematyki : próbujemy odczytać , jaka jest rozpuszczalność azotanu potasu KNO3 w temperaturze 60 0 C ?
Zaczynamy od znalezienia linii z opisem azotan potasu KNO3 ; odnajdujemy na osi temperaturę , idziemy pionowo do linii a potem znajdujemy punkt na osi rozpuszczalności
X KNO3 = 110 g w temp. 60 0 C
Notatka w zeszycie:
1.Rozpuszczalnością substancji w wodzie , określamy taką liczbę gramów substancji, która w danej temperaturze rozpuści się w 100 gramach wody , tworząc roztwór nasycony.
2. Badamy więc zawsze , ile gramów substancji znajduje sie w 100 gramach wody i tworzy z nią roztwór nasycony, tzn. taki , w którym w danej temperaturze nie „zmieści” się juz więcej substancji.
3. Rozpuszczalność będziemy oznaczali w ten sposób : X ( duże, drukowane X) ; np
X soli wynosi 40 g w temperaturze 30 stopni Celsjusza zapiszemy:
X soli = 40 g ( 300C) , taki zapis oznacza , że w 100 gramach wody , w temperaturze 300C rozpuszcza się 40g soli i tworzy roztwór nasycony. Masa całego roztworu wynosi : m = 40g soli + 100g H20 = 140 g roztworu.
Lekcja z dn. 21 i 23 kwietnia 2021r.
Praca na ocenę – plakat nt. Ochrony zasobów wodnych ( przyczyny, skutki i sposoby ochrony) – kryteria oceny i termin podam na MTeams 7 maja.

Dział : Woda i roztwory wodne.
Niedawno obchodziliśmy Światowy Dzień Wody, więc jesteśmy na bieżąco z tematami – są łatwe , większość informacji poznaliście już w klasach I-III. Jak zwykle będą zadania ( ale z wykorzystaniem procentów- to już przerabialiśmy) A tymczasem zapiszcie temat w zeszycie
Temat: Właściwości fizyczne wody . Występowanie wody w przyrodzie.
- Jak można opisać właściwości fizyczne wody???? – przeczytaj wiadomości ze stron 160-163 w podręczniku i obejrzyj filmy edukacyjne :
- uzupełnij notatkę w zeszycie:
Notatka :
1.Właściwości fizyczne wody : woda może występować jednocześnie w 3 stanach skupienia – ciekłym ( woda ), gazowym ( para wodna ) i stałym (lód).
- temperatura topnienia wody(lodu) ……0……0C czyli …..273……….. K
- temperatura wrzenia wody ( pod normalnym ciśnieniem ) wynosi ……….0C czyli ……………. K
- temperatura krzepnięcia wody …………………0C czyli ……………. K
- gęstość wody w 0 stopni Celsjusza ( 273 K) wynosi …….
- gęstość wody w 4 stopniach Celsjusza ( 281 K) wynosi……
- woda ma wysokie napięcie powierzchniowe , tzn. ……..
- woda ma duże ciepło właściwe, oznacza to …………..
- woda ma duże ciepło parowania , oznacza to………
- woda destylowana to ………………………….
- wody mineralne to ……………………………………………………, np. ………..
- Obieg wody w przyrodzie polega na ………….. ( 2, 3 zdania).
2.Woda jest bardzo dobrym rozpuszczalnikiem dla większości ciał stałych oraz dobrze miesza się z wieloma innymi cieczami. Wynika to z budowy polarnej jej cząsteczek, które są tzw. dipolami:
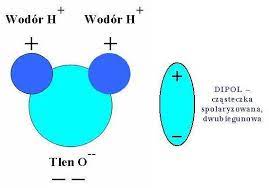

- roztwór właściwy to …..
- wyróżniamy następujące rodzaje roztworów : nasycony – to ………………, nienasycony – to ………………………….. i przesycony – to …………………………….
- zawiesina to………..
3. Szybkość rozpuszczania substancji w wodzie zależy od:
- ……..
- ……..
- …….
Skorzystajcie z podręcznika i obejrzyjcie filmiki
Na razie NIC nie odsyłacie – trzeba mieć notatkę w zeszycie.
🙂
Lekcja z dn. 16 kwietnia – karta pracy na ocenę.
Lekcja z dn. 9 kwietnia 2021r.
Temat : Obliczenia stechiometryczne
- Prawo zachowania masy.
- Prawo stałości składu
- Bilansowanie reakcji chemicznych.
https://epodreczniki.pl/a/prawo-zachowania-masy-i-stalosci-skladu/D14yrsg4f
w najbliższy piątek 16 kwietnia – praca na lekcji ( na ocenę )
Lekcja z dn.7.04.2021r.(plan)
Typy reakcji chemicznych – powtórzenie .
w najbliższy piątek 16 kwietnia – praca na lekcji ( na ocenę )


Lekcja z dn. 25.03( plan) i 27 .03. 2021 (MTeams)
Temat : Symbole , wzory i reakcje chemiczne – powtórzenie.
Naszym zadaniem jest usystematyzować dotychczasowe wiadomości i przygotować do pracy na lekcji ( na ocenę ) ;
W najbliższy piątek będziemy wykonywali typowe ćwiczenia sprawdzające pisanie wzorów, określanie rodzaju wiązań, określanie typów reakcji, układanie nazw systematycznych.
z nowych rzeczy – tabelka ściągawka – pobierz :
Lekcja z dn. 19 marca 2021r.
Temat : Rodzaje wiązań – ćwiczenia.
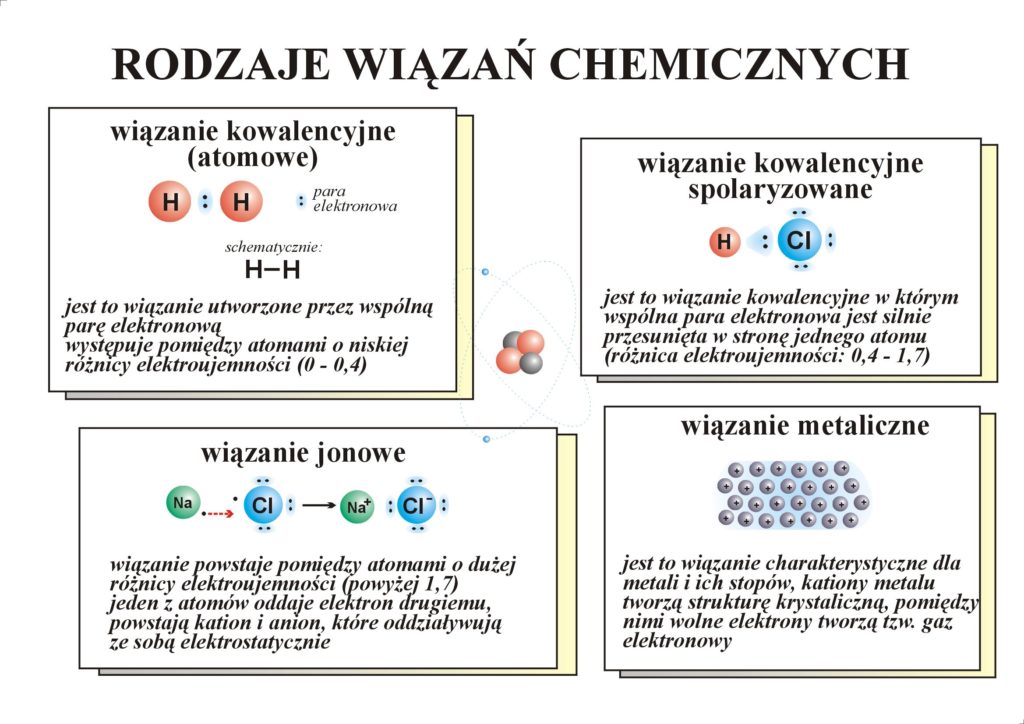
- Wiązanie atomowe ( kowalencyjne) – polega na uwspólnieniu elektronów z ostatniej powłoki elektronowej ( walencyjnej)
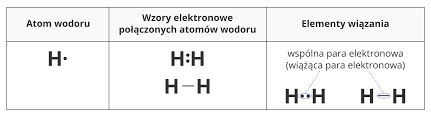

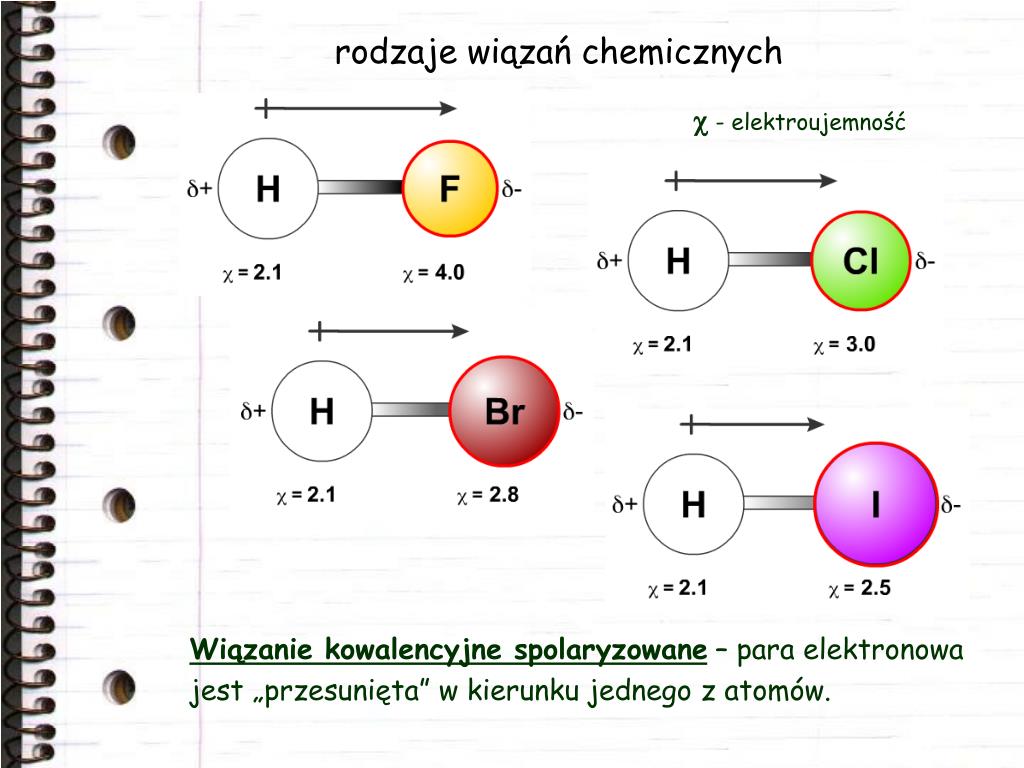
2. Wiązanie atomowe spolaryzowane – wiążąca para elektronów jest przesunięta w kierunku jądra atomu pierwiastka o większej elektroujemności .
3. Przykłady wiązań :
4. W praktyce szybko możemy określić rodzaj wiązania, korzystając z tzw. skali Paulinga:
Praca domowa na 26 marca : zadania 1,2,3, str. 120 ( podręcznik ) oraz 4 str. 120( dla chętnych) ; odsyłamy przez MTeams 🙂 wszystkie informacje do zadań w podręczniku – str. 110-119.
Lekcja z dn. 10 i 12 marca 2021r.
TEMAT : Rodzaje wiązań chemicznych czyli jak powstają cząsteczki związków chemicznych.
Na lekcji online omówimy 3 podstawowe rodzaje wiązań , które występują między atomami w cząsteczkach : wiązanie atomowe, spolaryzowane i jonowe.
Na lekcji online należy mieć : układ okresowy pierwiastków, tabelkę z wartościowościami i symbolami pierwiastków oraz chęć do pracy 🙂
Powtórzcie też wiadomości o oktecie elektronowym , pierwiastkach elektrododatnich ( I,II,III gr. UOP) , elektroujemnych ( V, VI, VII grupa UOP) i zasadach układania wzorów tlenków.
dla ciekawych :
Resztę omówimy na Mteams i dopiero wtedy podyktuję notatkę 🙂
koniec
lekcja z 5 marca 2021r. – kartkówka na MTEAMS 🙂
Lekcja z dn. 24 i 26 lutego 2021r.,
i lekcja dodatkowa z dn. 1 marca 2021r.
Temat: Podsumowanie wiadomości o atomach, cząsteczkach i UOP.
Przykładowe zadania na kartkówkę :
- Obliczanie masy cząsteczkowej: Oblicz masę cząsteczki tlenku żelaza (III). Układamy wzór: Fe2O3
m Fe2O3 = 2 mFe + 3mO = 2 . 56u + 3 . 16u =
2. Budowa atomu
Zapisz kolejne etapy upraszczania modelu budowy atomu fosforu aż do zapisu konfiguracji elektronowej ( i dla chętnych konfiguracji uproszczonej czyli przyrównania do atomu gazu szlachetnego):
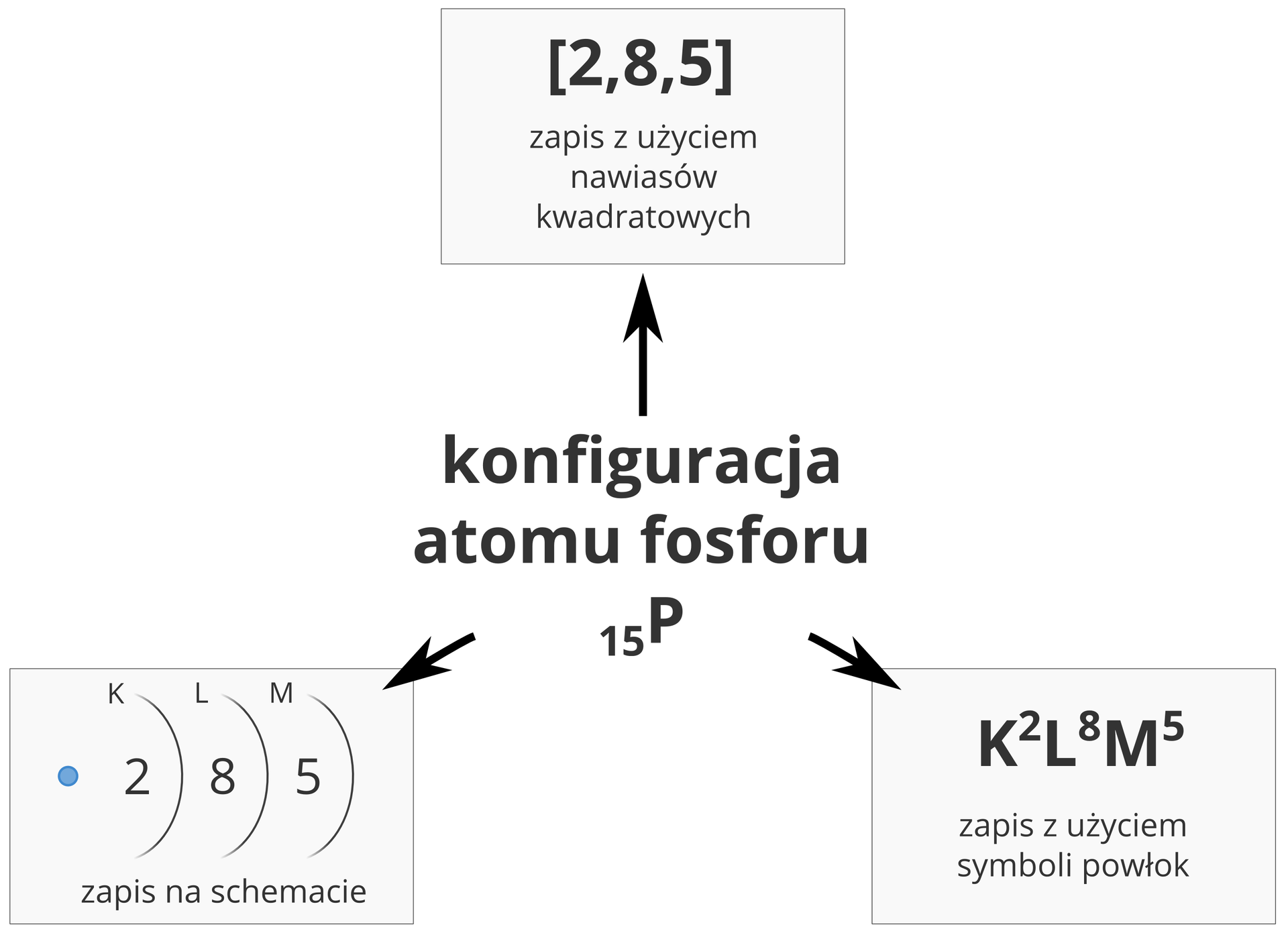
15P : K2L8M5
* lub zapis skrócony 15P: [10Ne] M5 czyli – fosfor wygląda tak jak atom gazu szlachetnego poprzedzającego go w UOP + jeszcze powłoka M z 5 elektronami . W reakcjach fosfor będzie „dążył ” do pozbycia się tych 5 elektronów( aby mieć konfigurację neonu) lub uzyskania dodatkowych 3 , aby mieć ich 8 , tak jak atom gazu szlachetnego (argon) kończącego ten sam okres. ( zwróćcie uwagę , że wartościowość fosforu to właśnie III i V).
8 elektronów , które pierwiastki „chcą mieć na ostatniej powłoce to tzw. OKTET ELEKTRONOWY ; wyjątkiem jest tzw. dublet elektronowy ( 2 elektrony ) u gazu szlachetnego helu z 1 okresu.
- 3. zaznacz prawidłową odpowiedź:

4. Uzupełnij dane o pierwiastku:
Symbol : K
Nazwa : potas
masa atomowa :39,098 u
liczba masowa : 39 u
liczba atomowa:19
Numer grupy: I (1)
rodzina: litowce
Liczba protonów ..19… , neutronów 20 …… , elektronów….. .19
Liczba elektronów walencyjnych : 1
liczba powłok elektronowych ;4
Konfiguracja elektronowa : K2L8M8N1
wzór tlenku; KI2OII
wzór wodorku: KIHI
5. Jaki to pierwiastek ?
a. K2L8M8 N2 – – to jest wapń
b. znajduje się w 3 okresie i grupie IV (14) —- to jest KRZEM
c. rodzina pierwiastków , w której wszystkie mają po trzy elektrony walencyjne( niezależnie od liczby powłok elektronowych ) to ………..BOROWCE….
6. Podkreśl pierwiastki, które są izotopami siarki:
7. Węgiel jest mieszaniną dwóch izotopów o podanych masach atomowych i zawartościach procentowych: 12 C (98,9%) , 13 C ( 1,1%) ; oblicz średnią masę atomową węgla.
8. Ułóż wzór tlenku azotu (III)
9. Podaj nazwę systematyczną : Cu2O
Podobne zadania będą na kartkówce 🙂 5 marca.
Lekcja z dn. 17 i 19 lutego 2021r.
Temat: Co to są izotopy?
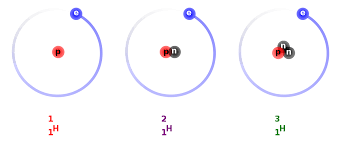
1. Izotopy – tak nazywamy atomy tego samego pierwiastka różniące się liczbą masową – wynika to z faktu , iż istnieją atomy , które mają różną liczbę neutronów w jądrze ale zawsze tą samą liczbę protonów ( liczbę atomową).
Przykłady – izotopy wodoru:

Izotopy tlenu:

Średnia masa atomowa , którą odczytujemy z UOP wynika z udziału procentowego izotopów w składzie.

ZADANIE ( zadanie rozwiążemy na Mteams)
Pierwiastek bor jest mieszaniną dwóch trwałych izotopów o składzie: 80,2 % 11B i 19,8 % 10 B . Oblicz średnią masę atomową tego pierwiastka.
Rozwiązanie
Zastosowanie izotopów :

praca domowa:
1.Korzystając z przykładu zrobionego na lekcji(poniżej) , narysuj kolejne modele budowy atomu siarki.
2. zadanie 7 str. 108 podręcznik.
Ćwiczenie : Narysuj model atomu glinu i jego kolejne uproszczenia:
13 27 Al
1. Pełny model:

2. wersja skrócona:

3. Zapis 13Al : K2 L8M3 – taki zapis nazywamy często konfiguracją elektronową .
Maksymalną liczbę elektronów na powłoce o danym numerze n , obliczamy ze wzoru :
2n2 , n= 1,2,3… ( licząc od jądra atomowego)
i jeszcze raz wszystko o glinie

3 elektrony na powłoce walencyjnej = III wartościowość glinu i jego umieszczenie w grupie (III) 13
Koniec lekcji 🙂
Lekcja z dn. 10 i 12 lutego 2021r.
Temat: Układ okresowy pierwiastków.
UWAGA!!
Na lekcji w dniu 12 lutego każdy z was musi mieć przed sobą przygotowany układ okresowy pierwiastków ( z podręcznika).
poniżej link do tzw. układu interaktywnego
https://ukladokresowy.edu.pl/#/forma/podstawowa
NOTATKA:
1.Układ okresowy pierwiastków ( inaczej tablica Mendelejewa ), jest to uporządkowane zestawienie wszystkich pierwiastków chemicznych. Pierwiastki chemiczne są tu uporządkowane według rosnącej liczby atomowej. Został wprowadzony w pierwotnej formie w 1869r.
2. Liczba atomowa określa liczbę protonów w jądrze atomu. Określa także liczbę elektronów w atomie w stanie obojętnym. Liczba ta jest jednocześnie kolejnym numerem pierwiastka w tym uporządkowaniu.
3.
CO MOŻEMY ODCZYTAĆ Z UKŁADU OKRESOWEGO PIERWIASTKÓW?
![]() Z – liczba atomowa = liczbie protonów = liczbie elektronów
Z – liczba atomowa = liczbie protonów = liczbie elektronów![]() A – liczba masowa = liczbie nukleonów (protonów i neutronów). Jej wartość jest równa zaokrąglonej liczbie całkowitej masy atomowej pierwiastka.
A – liczba masowa = liczbie nukleonów (protonów i neutronów). Jej wartość jest równa zaokrąglonej liczbie całkowitej masy atomowej pierwiastka.

![]() numer okresu = liczbie powłok elektronowych
numer okresu = liczbie powłok elektronowych![]() numer grupy (cyfra jedności) = liczbie elektronów walencyjnych
numer grupy (cyfra jedności) = liczbie elektronów walencyjnych![]() numer grupy (cyfra jedności) = maksymalnej wartościowości pierwiastka względem tlenu
numer grupy (cyfra jedności) = maksymalnej wartościowości pierwiastka względem tlenu![]() wartościowość pierwiastka w związkach z wodorem i innymi niemetalami = numerowi grupy (cyfra jedności), dla grup 1, 2, 13, 14, a dla grup 15 – 17 obliczamy : 18 odjąć nr grupy
wartościowość pierwiastka w związkach z wodorem i innymi niemetalami = numerowi grupy (cyfra jedności), dla grup 1, 2, 13, 14, a dla grup 15 – 17 obliczamy : 18 odjąć nr grupy![]() charakter chemiczny (metal, niemetal, półmetal)
charakter chemiczny (metal, niemetal, półmetal)![]() w każdej grupie, ze wzrostem numeru okresu, wzrasta charakter metaliczny pierwiastka
w każdej grupie, ze wzrostem numeru okresu, wzrasta charakter metaliczny pierwiastka![]() w każdej grupie, ze wzrostem numeru okresu, wzrasta liczba powłok elektronowych
w każdej grupie, ze wzrostem numeru okresu, wzrasta liczba powłok elektronowych![]() w każdym okresie, ze wzrostem numeru grupy, wzrasta liczba elektronów walencyjnych
w każdym okresie, ze wzrostem numeru grupy, wzrasta liczba elektronów walencyjnych![]() w każdym okresie, ze wzrostem numeru grupy, wzrasta charakter niemetaliczny pierwiastka
w każdym okresie, ze wzrostem numeru grupy, wzrasta charakter niemetaliczny pierwiastka![]() własności kwasowe pierwiastków wzrastają od lewej strony ku prawej, własności zasadowe – w kierunku przeciwnym
własności kwasowe pierwiastków wzrastają od lewej strony ku prawej, własności zasadowe – w kierunku przeciwnym
CIEKAWOSTKA
Dymitr Mendelejew (1834 – 1907) , pracował jako chemik w różnych działach tej dziedziny nauki, szczególnie w zakresie chemii roztworów. Wynalazł również pirokolodion, rodzaj prochu bezdymnego. Na jego pogrzebie studenci, chcąc uczcić swego ulubionego wykładowcę, nieśli transparent z układem okresowym pierwiastków chemicznych.
4. Ćwiczenia – podczas lekcji na MTeams.

Lekcja z dn. 29.01.i 03 lutego 2021r.
Temat : Budowa atomu.
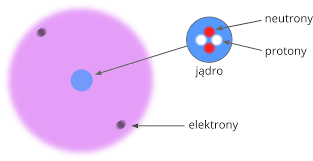
Atom – podstawowy składnik materii. Składa się z małego, dodatnio naładowanego jądra o dużej gęstości i otaczającej go chmury elektronowej o ujemnym ładunku elektrycznym. Wyjątek stanowi atom wodoru, który nie ma neutronu. Ładunek jądra atomowego jest dodatni, a jego wielkość jest równa liczbie protonów.
Słowo atom pochodzi z greckiego ἄτομος – átomos, oznaczającego coś, czego nie da się przeciąć ani podzielić. Wikipedia
1. Nowe pojęcia :
Proton – p, p+ – to cząstka elementarna obdarzona jednostkowym dodatnim ładunkiem elektrycznym i masie jednostkowej 1 u, składnik jądra atomowego.
elektron – e, e – , cząstka elementarna o jednostkowym , (elementarnym ) ujemnym ładunku elektrycznym i masie 1840 razy mniejszej od masy protonu, składnik atomu.
neutron -n, n0 -cząstka elementarna pozbawiona ładunku elektrycznego, o masie jednostkowej 1u, składnik jądra atomowego
Oddziaływania cząstek (FIZYKA) :

2.Budowa atomu
3. Średnica atomu mierzona jest w nanometrach:
1 nanometr , skrót 1 nm ;
1 nm = 0,000 001 mm ( 10-6 mm)
1 nm= 0,000 000 001 m ( 10-9m);
czasami stosujemy jednostkę 10 razy mniejszą , tzw. 1 Angstrem.
Każdy atom ma inna masę, wielkość i właściwości, które charakteryzują dany pierwiastek.
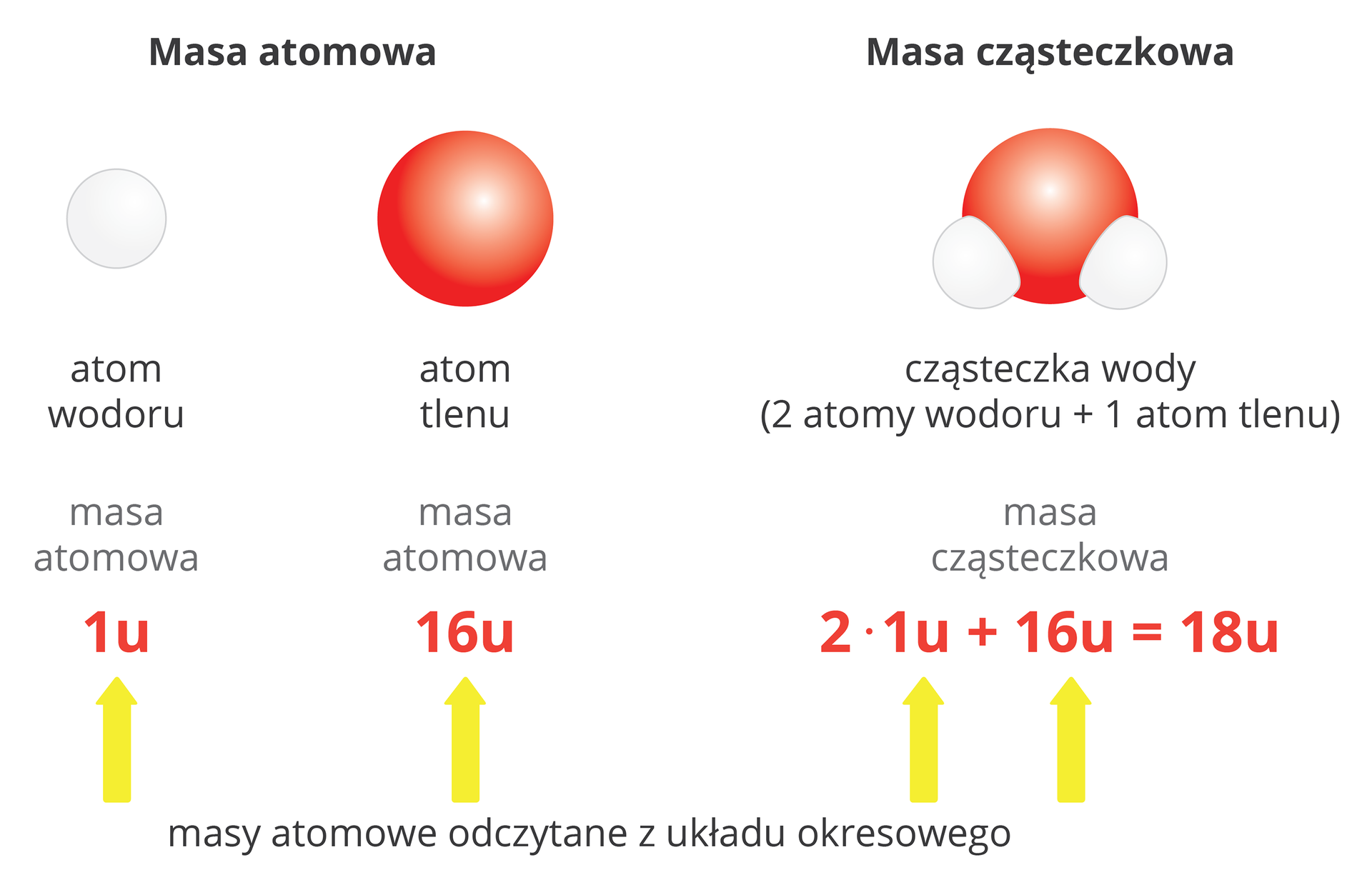
4. Masa atomu: jest sumą głównie protonów i neutronów, a więc jest skupiona w jądrze atomowym; masy elektronów są 1840 razy mniejsze, więc nie wpływają na masę całego atomu w wyraźny sposób. Aby określić tak małą masę pojedynczych atomów, wprowadzono jednostkę umowną :
1u =1/12 masy atomu węgla wzorcowego 12C
1 u (unit) = 1/12 masy ¹²C = 1,66054 × 10⁻²⁴ grama = 1,66054 × 10⁻²⁷ kg.
PRZYKŁAD:
mH =1 u – oznacza to ,ze jeden atom wodoru ma masę równa 1/12 masy atomu węgla wzorcowego,
mO = 16 u – oznacza to, że 1 atom tlenu ma masę 16 razy większą od 1/12 masy atomu węgla wzorcowego
masa cząsteczkowa to suma mas wszystkich atomów wchodzących w jej skład :

cdn.
Lekcja z dn. 20.01.2021r. ( plan) i 22 stycznia 2021r. -MTeams.
Przypomnienie 🙂
Temat: Modelowanie cząsteczek i równań reakcji chemicznych.
Filmiki do obejrzenia – tłumaczenie w piątek na Teamsach 🙂
koniec
lekcja nr 13. z dn . 18.12.2020r.
Temat: Sprawdzian wiadomości z działu >> Składniki powietrza i przemiany, jakim one ulegają <<
lekcja nr 12 z dn. 16.12.2020r.
Temat : Atomy i cząsteczki. Masa atomowa i masa cząsteczkowa.
Lekcja nr 11. z dn. 11 grudnia
Lekcja nr 10 z dn.09.12.2020r.
Temat : Równania reakcji chemicznych. Prawo zachowania masy.
Notatka:
Podstawowym prawem, które musimy spełnić aby prawidłowo zapisać równanie reakcji chemicznej, jest spełnienie prawa zachowania masy:
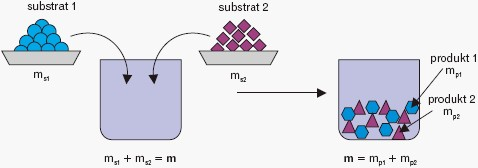
W praktyce oznacza ono, że ilości atomów poszczególnych pierwiastków po obu stronach równania musza być równe.
PYTANIE ???
KTO SFORMUŁOWAŁ PRAWO ZACHOWANIA MASY ???
Przykłady zapisu reakcji na MTeams w piątek, 11 grudnia
lekcja nr 9, zdn.02.12.2020r.
Temat : 2.Układanie wzorów tlenków i wodorków pierwiastków – cd.
Lekcja w piątek na MTeams ; należy mieć przepisaną notatkę z poprzedniej lekcji ( punkt 2)
https://epodreczniki.pl/a/tlen-i-tlenki/DeoaBkF4n
Lekcja nr 8 , 27.11.2020r.
Temat : Rodzaje reakcji chemicznych ; powtórzenie o składnikach powietrza
1. powtórzenie
Uzupełnij tabelkę :
| Rodzaj zanieczyszczenia | Skutek tego zanieczyszczenia | Sposoby zmniejszania skutków |
| Tlenki siarki I azotu | ||
| Dwutlenek węgla | ||
| freony | ||
| Smog * |
*Dla chętnych
przypomnienie doświadczenia z lekcji :

2.Układanie wzorów tlenków i wodorków pierwiastków:
Tlenki to połączenia chemiczne ( związki chemiczne) tlenu z innymi pierwiastkami. Dobrze znanymi Wam tlenkami są tlenek wodoru ( woda) i dwutlenek węgla :
H2O– tlenek wodoru , monotlenek diwodoru , woda
CO2 – tlenek węgla (IV) , ditlenek monowęgla, dwutlenek węgla
Wodorki to związki chemiczne wodoru z innymi pierwiastkami; znacie np. : siarkowodór ( H2S) , amoniak ( NH3)
Jak poprawnie ułożyć wzór cząsteczki związku chemicznego i reakcję jego otrzymywania??
Reszta wiadomości na MTeams- przypomnijcie sobie symbole pierwiastków i ich wartościowości 🙂
Lekcja nr 7 z dn.20.11.2020.(Mteams)
Temat : Przyczyny i skutki zanieczyszczenia powietrza.
Rozmawialiśmy dzisiaj o przyczynach i skutkach zanieczyszczeń powietrza.



Notatka w zeszycie :
I.Przyczyny :
a.naturalne : np.wybuchy wulkanów, wyładowania atmosferyczne, pożary
b.antropogeniczne ( wynikające z działalności człowieka ): np. wynikające z produkcji paliw, farb lakierów, nawozów; spalania ( fabryki i gospodarstwa domowe); katastrof w zakładach przemysłowych i transporcie.
II. Skutki:
a.efekt cieplarniany
b. dziura ozonowa
c. kwaśne opady
d. smog
e. obumieranie fauny i flory
f. choroby dróg oddechowych, mutacje , nowotwory, choroby genetyczne.
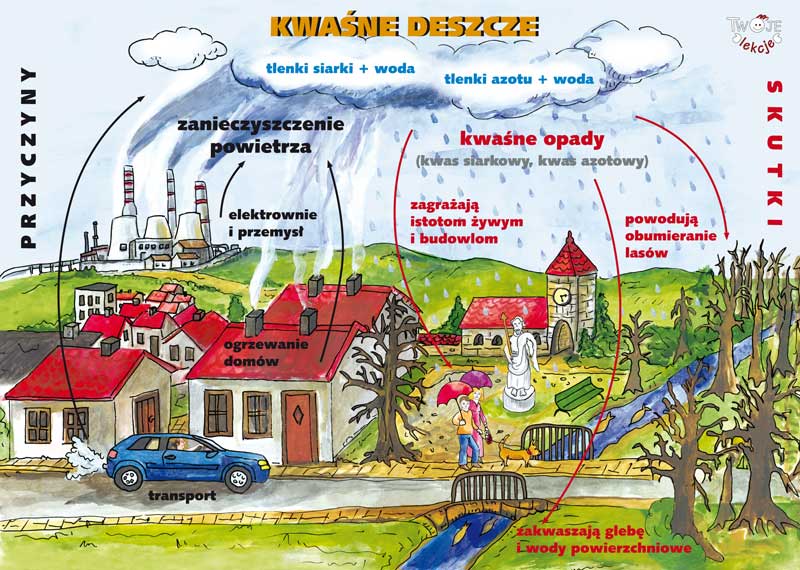
III. Sposoby ochrony powietrza -te zagadnienia omówimy 27.11.
Praca domowa zadana na MTeamsach – wykonać plakat nt. przyczyn lub skutków zanieczyszczeń powietrza. ( odesłać przez teamsy do czwartku, 26.11.
Koniec lekcji.
Lekcja Nr 6 z dnia 18.11.2020r.
Temat : Powtórzenie wiadomości o składnikach powietrza .
W zasobach Microsoft Teams udostępniłam serię krótkich filmików – jest to powtórka przed kartkówką w dniu 20 listopada br.- polecam . Zakres wiadomości na kartkówkę wysłałam przez mobidziennik .
do zobaczenia w najbliższy piątek
Lekcja 5 z dn. 13.11.2020r. na MT
Temat: Wodór- właściwości i jego reakcja charakterystyczna .
1.Wodór to najlżejszy z gazów HI( Hydrogenium) , występuje jako cząsteczka H2– jest to bezbarwny, bezwonny, bezsmakowy, nietoksyczny, łatwopalny gaz.
Wodór po raz pierwszy otrzymano sztucznie na początku XVI wieku w reakcji metalu z kwasem. W latach 1766–81 Henry Cavendish stwierdził, że wodór jest oddzielną substancją chemiczną, po spaleniu której powstaje woda. Właściwość ta zadecydowała o nazwie tego pierwiastka chemicznego, bowiem w języku greckim υδρογόνο (ydrogóno) oznacza „tworzący wodę”.
wodór + tlen = tlenek wodoru ( woda) – jest to reakcja syntezy, utleniania, spalania, egzoenergetyczna
Reszta materiału na teamsach i przygotowujemy się do powtórzenia – kartkówka 20 listopada .
Ciekawostka
koniec lekcji 5
Lekcja 4 z dn. 06.11.200r. na MTeams
Temat : Dwutlenek węgla i jego właściwości

Przypomnieliśmy sobie gdzie występuje dwutlenek węgla, skąd pochodzi ( procesy spalania i oddychania), jaką pełni rolę w środowisku( fotosynteza) i jakie stanowi zagrożenia ( gaz cieplarniany). Bardzo ważnym pojęciem ,związanym z CO2 jest tzw. obieg węgla w przyrodzie – biologiczne, chemiczne i fizyczne procesy zachodzące na Ziemi, w wyniku których następuje ciągła wymiana węgla jako pierwiastka znajdującego się w atmosferze, w wodzie, organizmach żywych, ich szczątkach oraz w skorupie ziemskiej:( możesz powiększyć grafikę przez >>kliknięcie<<

Na podstawie obejrzanych filmów , podręcznika i lekcji uzupełnij notatkę:
właściwości chemiczne dwutlenku węgla:
właściwości fizyczne :
zastosowanie:
suchy lód to………
Praca domowa. ( zadana taka sama jak na teamsach ): Na czym polega reakcja charakterystyczna dwutlenku węgla?
Wszystkie informacje do obejrzenia :
Koniec lekcji 4 🙂
lekcja 3 z dn. 04.11.2020r.
Temat: Reakcje spalania i utleniania.
Reakcja chemiczna to proces, w którym następuje przemiana substancji i powstają nowe o zupełnie innych własnościach fizycznych i chemicznych .
W szkole oglądaliśmy doświadczenia -np. spalanie magnezu – co powstaje w takiej przemianie ?
NOTATKA :
Pierwiastki : magnez, siarka i węgiel łączą się z tlenem i powstają tlenki tych pierwiastków:
Magnez + tlen = tlenek magnezu
siarka + tlen = tlenek siarki (IV)
węgiel + tlen = tlenek węgla (IV)
Reakcja, w której 2 lub więcej pierwiastków łączą się ze sobą dając nowy związek chemiczny nazywana jest reakcją łączenia lub syntezy chemicznej; substancje, które biorą udział w reakcji ( reagują ) to substraty; substancje , które powstają to produkty; substraty i produkty nazywamy łącznie reagentami.
Reakcja syntezy , w której pierwiastki łączą się z tlenem to reakcja utleniania.
Reakcja utleniania , w której reagenty wydzielają światło i ciepło to reakcja spalania.
Reakcja, w której do otoczenia wydzielana jest energia ( ciepło) to reakcja egzoenergetyczna.
Reakcja, w której substraty wymagają energii(np. podgrzania ) aby zaczęły reagować to reakcja endoenergetyczna.
Reakcją odwrotną do reakcji syntezy jest reakcja analizy czyli rozkładu, np.:
tlenek rtęci = rtęć + tlen substrat to tlenek rtęci, produkty to tlen i rtęć.
cdn. na Teamsach
koniec lekcji 3
Lekcja 2, 30.10.2020r.
Temat: Otrzymywanie tlenu i jego reakcja charakterystyczna.
Reakcja charakterystyczna to sposób na 100% rozpoznanie substancji – tylko dana substancja zachowuje się podczas reakcji w ten sposób i dzięki takiej reakcji możemy identyfikować różne pierwiastki i związki chemiczne.
podsumowanie: Reakcja charakterystyczna tlenu polega na rozpaleniu żarzącego się łuczywka pod jego wpływem.
koniec lekcji nr 2 🙂
lekcja 1, 28.10.2020r.
Temat:Tlen, najważniejszy składnik powietrza.
Rozmawialiśmy na „teamsach”, dlaczego uważamy tlen za gaz o bardzo dużym znaczeniu dla życia na Ziemi- jest niezbędny do oddychania ludzi i zwierząt oraz pozyskiwania energii w procesach spalania .
W szkole przeprowadziliśmy doświadczenie, które wykazało,że tlen stanowi około 1/5 objętości powietrza.
Jakie tlen ma własności ?
Tlen to gaz bezbarwny, bezwonny,podtrzymujący palenie.
Tlen można otrzymać: * podczas termicznego rozkładu manganianu(VII) potasu, * rozkładu wody utlenionej (w obecności katalizatora)* lub podczas rozkładu wody pod działaniem prądu elektrycznego (elektrolizy wody). Przemysłowa metoda otrzymywania tlenu polega na destylacji ciekłego powietrza. zobacz – skopiuj link : https://nowahistoria.interia.pl/kartka-z-kalendarza/news-5-kwietnia-1883-r-karol-olszewski-i-zygmunt-wroblewski-skrop,nId,1709770
Kto odkrył tlen ?? CIEKAWOSTKI
Pierwszym odkrywcą tlenu najprawdopodobniej był żyjący w XVI wieku na dworze Zygmunta III Wazy alchemik Michał Sędziwój.
Tlen został odkryty ponownie przez Carla Sheele przed rokiem 1773, ale odkrycie nie zostało opublikowane do roku 1777. W tym czasie za odkrywcę tlenu od dwóch lat uznawany był Joseph Priestley, który otrzymał tlen ogrzewając tlenek rtęci(II) i zbierając wydzielający się gaz.
Łacińska nazwa tlenu oxygenium (z gr. oksy – kwaśny, gennao – rodzę), wprowadzona została przez Antoine Lavoisiera.
Polska nazwa „tlen” wywodzi się od słowa „tlić” i została nadana przez Jana Oczapowskiego. Wcześniejsza polska nazwa „kwasoród” była dosłownym tłumaczeniem łacińskiej, a wprowadził ją Jędrzej Śniadecki.
Koniec lekcji 1