
Witam chemików z klas 8-ych.
Jak mówiłam na Teamsach, będą tu zamieszczane najważniejsze, czasem dodatkowe materiały, których nie zdążymy omówić na MT.
12 maja 2021r.
Temat : Właściwości i zastosowanie estrów .
- przypominamy sobie , jakie związki chemiczne nazywamy estrami? ( lekcja poniżej)
- dlaczego estry są tak ważną grupą związków organicznych?

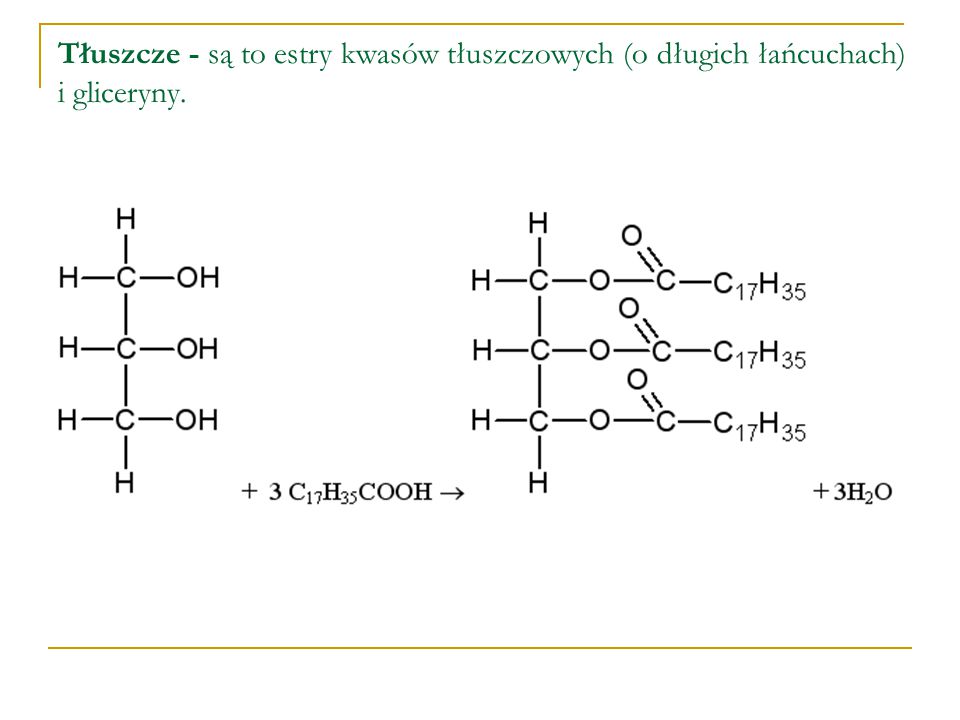

3.Estry produkuje się jako zamienniki drogich zapachów naturalnych – do produkcji perfum i aromatyzowania serków, jogurtów, napojów ,itp. oraz jako rozpuszczalniki .
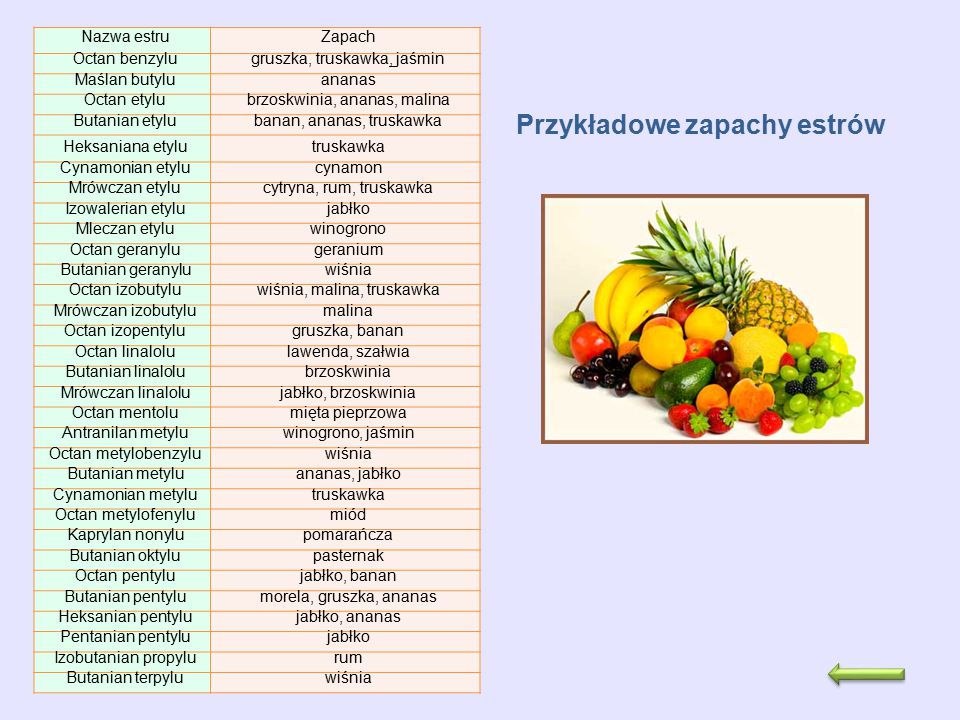
Ćwiczenie :
a.wybierz 5 nazw zapachów – spróbuj ułożyć wzory tych estrów; b.ułóż reakcję otrzymywania butanianu etylu oraz reakcję jego spalania całkowitego.
Praca domowa – w zeszycie , sprawdzenie zadań w szkole :
ćwiczenia: 72,73str 103 ; 74, 75 str 104; dla chętnych ćw. 76 str 104 z przesłanego wcześniej zeszytu ćwiczeń.

Lekcja z dn. 5 maja 2021r.
T: Reakcje kwasów organicznych z alkoholami. Reakcja estryfikacji.
NOTATKA :
- Reakcja estryfikacji polega na dzialaniu kwasem organicznym na alkohole ; ważną rolę ( jako katalizator pochłaniający powstającą w reakcji wodę), pełni stężony kwas siarkowy , który ma własności higroskopijne.
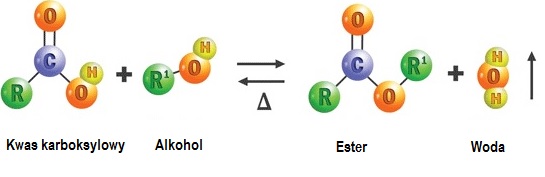
- schemat reakcji: kwas karboksylowy+ alkohol = ester +woda
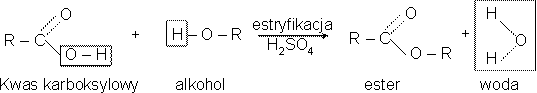
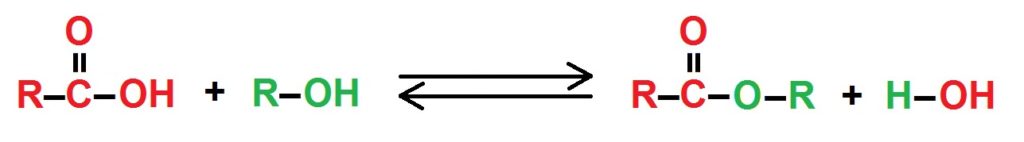
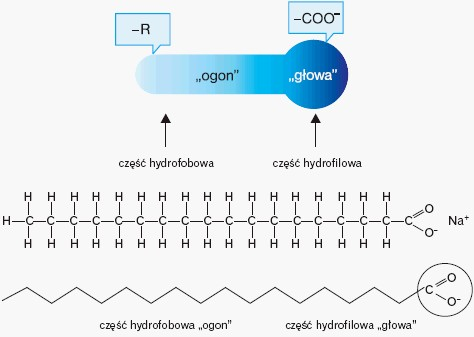
schemat ogólny powstawania estrów – R oznacza grupę alkilową , kolor czerwony – część od kwasu , zielony – atomy pochodzące od alkoholu
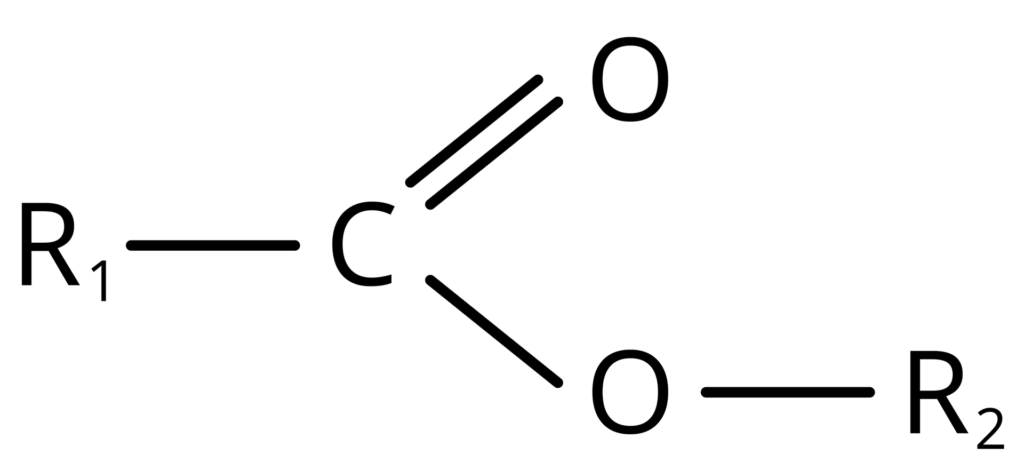
grupa [-COO-] to grupa funkcyjna estrów.
UZUPEŁNIJ :
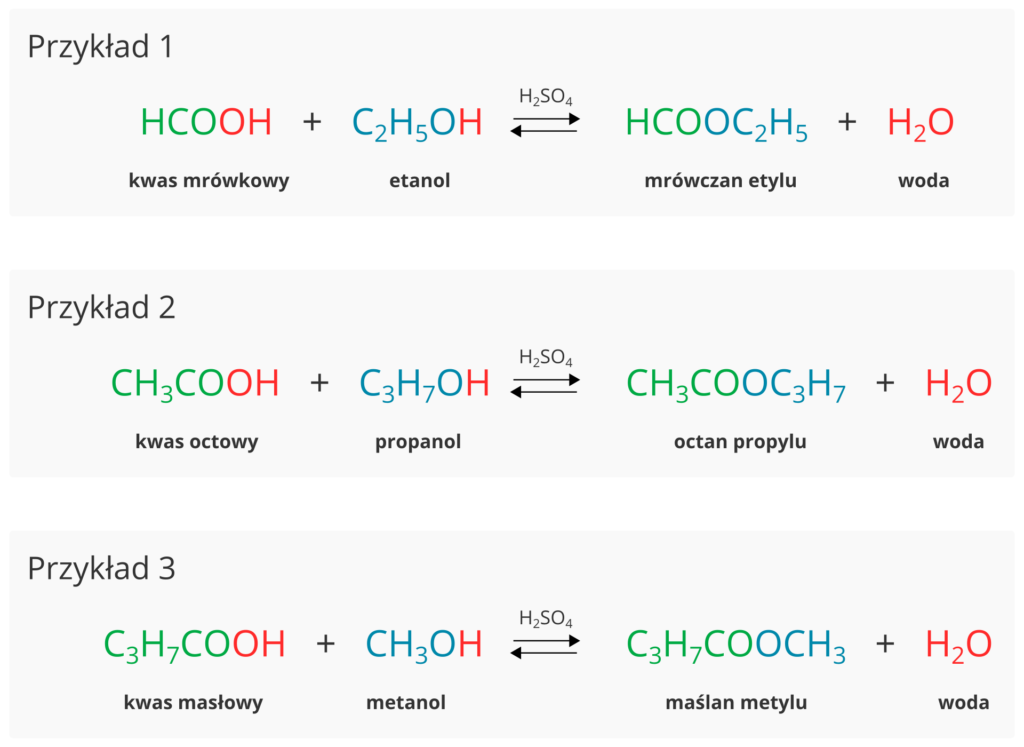
- Estrem , który ma bardzo dużo zastosowań jest octan etylu. Służy on m.in. do: 1.………………………………………… 2. ………………………….3. ………………………………………………………………………………………………
- Reakcja otrzymywania octanu etylu : ………………………………………………………………………………………………………
- Nazwa systematyczna octanu etylu to ………………… ……………… .
- przeczytaj strony w podręczniku: 177 i następne
Lekcja z dn. 28.04.2021r.
Temat: Wyższe kwasy karboksylowe.



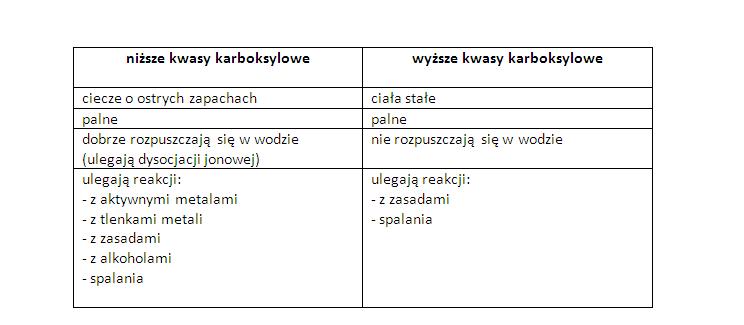
zeszyt ćwiczeń – pobierz
Lekcja z dn. 21 kwietnia 2021r.
Temat. Właściwości kwasów organicznych.
Na MTeams omówimy i zapiszemy reakcje :
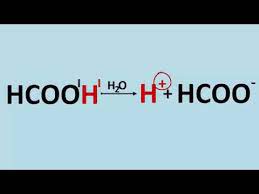
- dysocjacji
HCOOH = HCOO– + H+
WODÓR KWASOWY TO WODÓR W GRUPIE FUNKCYJNEJ KWASÓW
kwas mrówkowy = anion kwasu mrówkowego + kation wodorowy
kwas metanowy = anion mrówczan ( metanian) + kation wodorowy
2.reakcje powstawania soli ; nazwy soli organicznych
a. reakcja kwasu mrówkowego ( metanowego) z metalem:
2 HCOOH + 2 Na → 2 HCOONa + H2↑
sól HCOONa nazywamy mrówczanem sodu ( metanian sodu)
b. kwasu mrówkowego z tlenkiem sodu:
2 HCOOH + Na2O → 2 HCOONa + H2O
c.. kwasu mrówkowego z wodorotlenkiem sodu:
HCOOH + NaOH → HCOONa + H2O.
Przykład wzoru strukturalnego mrówczanu w przypadku soli metalu dwuwartościowego – MRÓWCZAN WAPNIA
ANION RESZTY KWASOWEJ kwasów jednokarboksylowych jest zawsze I wartościowy.
Przykłady zastosowań soli kwasu mrówkowego
- w przemyśle chemicznym do produkcji podsiarczynu sodowego, kwasu szczawiowego i kwasu mrówkowego
- w przemyśle paszowym jako dodatek do pasz dla bydła
- w przemyśle perfumeryjnym przy produkcji środków zapachowych
- w przemyśle skórzanym jako sól maskująca w chromowej metodzie garbowania skór
- w przemyśle włókienniczym jako składnik kompozycji stabilizacyjnych i jako czynnik redukcyjny przy drukowaniu i farbowaniu tkanin
- w przemyśle papierniczym do impregnacji papieru
- mrówczan sodu w niektórych przypadkach jest stosowany jako środek konserwujący w żywności jako E237
- w branży budowlanej – wpływa na proces twardnienia betonu, znacznie go przyspieszając.
- w paszach – jest jednym z dodatkowych składników podczas produkcji pasz dla zwierząt hodowlanych.
- nawóz do jabłek i gruszek – zapobiega plamistości podskórnej, zbrunatnieniu skórki oraz zbrunatnieniu miąższu owoców.
3. reakcje spalania
a. spalanie kwasu mrówkowego
np. spalanie całkowite:
2HCOOH + O2 –> 2CO2 + 2H2O

przy bilansowaniu równań spalania kwasów karboksylowych należy pamiętać o uwzględnieniu tlenu zawartego w grupie karboksylowej.
b. uzupełnij ( 3 rodzaje spalania kwasu octowego)
Utrwal wiadomości :
Koniec lekcji
Lekcja z dn.14 kwietnia 2021r.
Temat : Szereg homologiczny kwasów jednokarboksylowych .
1.Kwasy karboksylowe – to grupa organicznych związków chemicznych zawierająca jednowartosciwą grupę karboksylową [ – COOH].
2.Kwasy karboksylowe są pochodnymi węglowodorów, w których atom wodoru zostaje zastąpiony grupą funkcyjną: karboksylową — COOH.

3.Nazwy systematyczne kwasów tworzymy od nazwy węglowodoru, który posiada tyle samo atomów węgla co kwas, dodając końcówkę -owy, np.:

4.Wzory i nazwy :
kwas metanowy HCOOH
kwas etanowy CH3COOH
kwas propanowy C2H5COOH
.
.kwas dekanowy C9H19COOH
Wszystkie kwasy zawierające 1 grupę karboksylową tworzą szereg homologiczny o wzorze ogólnym: R-COOH ; gdzie R to grupa alkilowa lub wodór ( tylko w kwasie metanowym) : – H , -CH3, -C2H5,…..,CnH2n+1
Kwas metanowy HCOOH nazywany jest zwyczajowo kwasem mrówkowym ; występuje np………………….
Kwas etanowy CH3COOH to zwyczajowo kwas octowy.
Ponieważ ( jak pamiętamy ?? 🙂 ,kwasy mają zawsze w swojej cząsteczce wodór, który podczas reakcji dysocjacji odszczepia się w postaci kationu wodorowego ( protonu);to kwasy organiczne muszą również taką własność mieć ; Pytanie : który wodór w kwasie organicznym jest kwasowy ???
Czytaj więcej na https://opracowania.pl/opracowania/chemia/kwasy-karboksylowe,oid,2140#utm_source=paste&utm_medium=paste&utm_campaign=other
Lekcja z dn. 7 kwietnia 2021r.
Temat :Porównanie właściwości alkoholi – ćwiczenia.
Na MTeams wystawiłam kartę pracy jako zadanie domowe na 13 kwietnia; podobne zadania przerobimy dzisiaj na lekcji.
Proszę powtórzyć : definicja pochodnych, definicja alkoholi mono- i polihydroksylowych, definicja grupy funkcyjnej; rodzaje reakcji spalania oraz wzór na stężenie procentowe (kl. 7) a także podstawowe wzory i nazwy alkoholi.


Lekcja z dn.29 i 31 marca 2021r.
Temat : Przykłady alkoholi wielowodorotlenowych. Glikol i glicerol.
Zgodnie z definicją, pochodne powstają wtedy, gdy w węglowodorze podstawimy grupę funkcyjną zamiast jednego( lub więcej niż jednego) wodoru.
Np. w przypadku grupy funkcyjnej alkoholi [ – OH] , możemy ją podstawić w 2 lub 3 miejscach – powstaną wtedy alkohole wielowodorotlenowe ( polihydroksylowe).
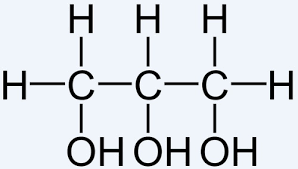
1.Przykładem takiego alkoholu jest alkohol dwuwodorotlenowy ( dihydroksylowy) -etanodiol
( 1,2- etanodiol), nazywany popularnie glikolem:
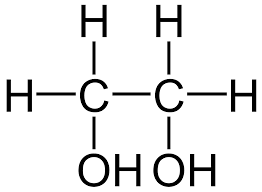
2.lub alkohol trójwodorotlenowy ( trihydroksylowy),
1,2,3- propanotriol, nazywany glicerolem lub gliceryną :
Właściwości i zastosowanie : na Mteams
Lekcja z dn.25 marca 2021r.
Temat: Szereg homologiczny alkoholi jednowodorotlenowych .
1. Alkohole jednowodorotlenowe ( monohydroksylowe) to pochodne węglowodorów, w których jeden atom wodoru zastąpiono grupą funkcyjną alkoholi – tzw. grupą hydroksylową ( wodorotlenową) – OH(I-wartościową)
2. Przykłady :
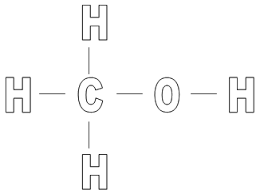
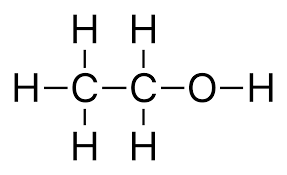
Wzór ogólny
CnH2n+1OH lub R-OH; gdzie R to tzw. grupa alkilowa np: – CH3;
-C2H5
3. Właściwości alkoholi:
4. Reakcje spalania alkoholi:
CH3OH + 3/2O2 = CO2 + 2H2O
| Nazwa | ||
| Inne nazwy | ||
| Wzór sumaryczny | ||
| Wzór strukturalny | C2H5– OH | |
| Właściwości fizyczne | 1.gęstość= 2. T.wrz.= 3. rozpuszczalność w H20 | 1.gęstość = 2. T.wrz.= 3. rozpuszczalność w H20 |
| Właściwości chemiczne | 1.smak 2. zapach 3. palność | 1.smak 2. zapach 3. palność |
| Otrzymywanie | 1. 2. | 1. 2. |
| Zastosowanie | 1. 2. | 1. 2. |
Ćwiczenie
Zapisz reakcje spalania całkowitego: a) alkoholu butylowego; b)C7H15OH
5. Zdrowotne i społeczne skutki choroby alkoholowej:
Lekcja z 18.03( egzamin próbny)
Lekcja z dn. 8 i 11 marca ( wg. dziennika)
10 marca rozwiązujemy karty pracy online ale już dziś wystawiam parę informacji z nowego tematu , jeżeli do 18 marca przepiszecie notatkę, to będzie sie lepiej pracowało na teamsach 🙂
TEMAT : Pochodne węglowodorów .
Co to są pochodne ? – jak nazwa wskazuje, są to związki organiczne pochodzące od węglowodorów; mówiliśmy juz o nich przy okazji reakcji chlorowania i bromowania węglowodorów – np. pochodną węglowodoru nasyconego ( metanu) jest chlorek metylu ( monochlorometan) CH3Cl – jego ” szkielet ” węglowy jest taki sam jak w metanie.

Taki związek nie jest ” czystym węglowodorem” – zawiera atom innego pierwiastka- chloru.
NOTATKA
1.Pochodne węglowodorów to takie związki organiczne , w których zamiast jednego ( 2 lub więcej) wodoru w łańcuchu podstawiono atom lub grupę atomów innych pierwiastków.
2.Grupa takich atomów nazywa się GRUPĄ FUNKCYJNĄ i wpływa ona na charakter chemiczny tak otrzymanych pochodnych , które tworzą szeregi homologiczne.
! W klasie 8 omawiać będziemy szeregi pochodnych : alkohole, kwasy karboksylowe , estry, aminy , aminokwasy – tematy te będą bardzo powiązane z biologią !!
Przykładowy wzór jednej z pochodnych etanu : grupą funkcyjną jest grupa [ – OH ] , nazywana w chemii organicznej grupą HYDROKSYLOWĄ
Reszta informacji na Mteams 18 marca 🙂
Lekcja z dn. 1 marca i 3 marca 2021r.
Temat: Podsumowanie wiadomosci o węglowodorach.
Na lekcji online omówimy i przerobimy przykłady :
- Porównanie własności alkanów, alkenów i alkinów.
- pisanie wzorów sumarycznych , strukturalnych, grupowych.
- Reakcje spalania.
- Obliczanie składu procentowego .
- Reakcje z wodą bromową, nazywanie produktów reakcji
- Przykłady zastosowań metanu, etenu i etynu.
Jest to równocześnie zakres materiału na kartkówkę 10 marca dla obu klas .
Lekcja z dn. 24 i 25 lutego 2021r.
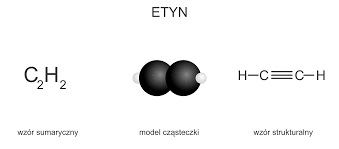
Temat: Szereg homologiczny węglowodorów nienasyconych z jednym potrójnym wiązaniem.
1.Alkiny to szereg homologiczny węglowodorów, które posiadają w łańcuchu jedno wiązanie potrójne ( ) ;są też węglowodorami nienasyconymi , ponieważ obecność wiązania potrójnego powoduje ich dużą aktywność chemiczną ( łatwo reagują np. z chlorowcami( chlor, brom, fluor) i chlorowcowodorami ( HCl, HBr, HF).
2.Wzory i nazwy alkinów tworzymy od szeregu alkanów,ZMIENIAJĄC KOŃCÓWKĘ -AN na -YN(-IN), przy tej samej liczbie atomów węgla w cząsteczce, np.:
ALKAN – ALKEN – ALKIN
ETAN C2H6 – ETEN C2 H4 – ETYN C2H2
Do najważniejszych alkinów zaliczamy etyn ( kiedyś nazywany acetylenem)
Praca domowa – bez odsyłania ; wybrane osoby odczytają lub pokażą prace do kamerki, tak jak dzisiaj.
Zadania : 1,2,3,- strona 125 ( podręcznik) oraz 1,2,3,4,5*, 7* , strona 130 ( podręcznik); * – dla chętnych ; ponadto : Wyjaśnić, na czym polega proces pirolizy ( i pirolizy metanu- str. 130)
LEKCJA Z DN. 17 LUTEGO 2021r.
DODATEK do lekcji – nazewnictwo związków powstałych w reakcjach węglowodorów :
Nazwy nadajemy od tzw. grup alkilowych (jednowartościowych) , czyli ” kawałków” węglowodorów nasyconych, z których odłączono 1 wodór:
CH4 metan – CH3 metyl ( grupa metylowa)
C2H6 – etan – C2H5 – etyl ( grupa etylowa)
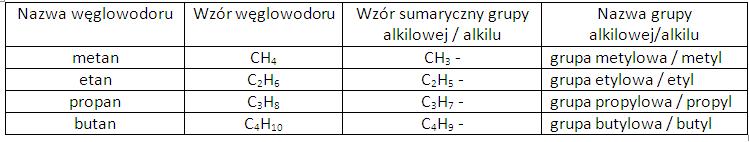
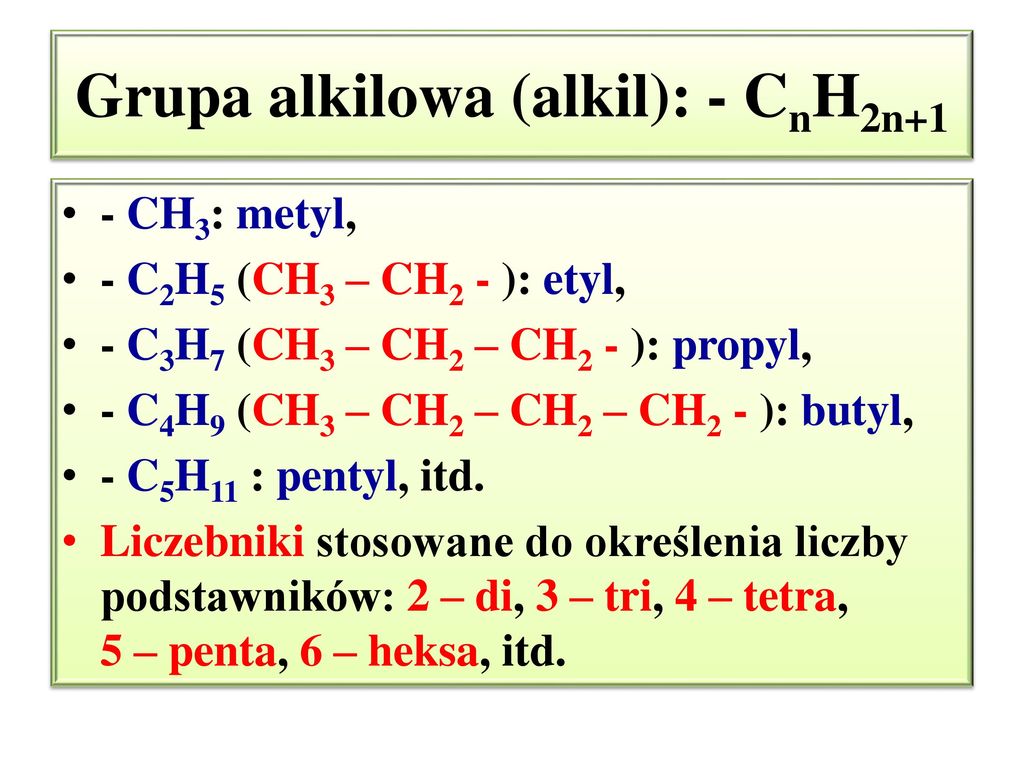
Alkan CnH2n+2 – Alkil ( grupa alkilowa) CnH2n+1
informacje są w podręczniku na str. 138 ( tabela)
Temat: Reakcje alkenów .
zapis reakcji i tłumaczenie – MTeams
- Reakcje spalania
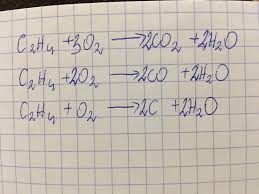
- Reakcje addycji
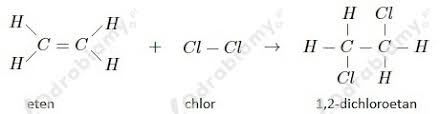
- Reakcje z chlorowcowodorami
- Reakcja charakterystyczna alkenów – wykrywanie wiązania podwójnego.
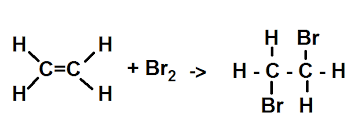
Praca domowa ( na następną lekcję 24.02):
- Zapisz wszystkie rodzaje reakcji spalania butenu.
- Za pomocą wzorów sumarycznych i strukturalnych zapisz reakcję propenu z wodą bromową ; podaj nazwę produktu.
- Dla chętnych:

- Dla ciekawych 🙂 https://www.youtube.com/watch?v=y52AO8DlNNk
Koniec lekcji 🙂
Lekcja z dn. 4 i 9 lutego 2021( 8a i 8b)
Temat: Szereg homologiczny alkenów.
Na pierwszej lekcji o węglowodorach mówiliśmy o szczególnych właściwościach węgla organicznego – jest on zawsze IV-wartościowy a jego atomy mogą łączyć się między sobą wiązaniami pojedynczymi( alkany) a także wiązaniami podwójnymi i potrójnymi.
Notatka:
Definicja:
1.Alkeny to szereg homologiczny węglowodorów, które posiadają w łańcuchu jedno wiązanie podwójne ( =) ;nazywamy je węglowodorami nienasyconymi , ponieważ obecność wiązania podwójnego powoduje ich aktywność chemiczną ( łatwo reagują np. z chlorowcami( chlor, brom, fluor) i chlorowcowodorami ( HCl, HBr, HF).
2.Wzory i nazwy alkenów tworzymy od szeregu alkanów,ZMIENIAJĄC KOŃCÓWKĘ –AN na –EN, przy tej samej liczbie atomów węgla w cząsteczce, np.:
ALKAN – ALKEN
ETAN C2H6 – ETEN C2 H4
PROPAN C3H8 – PROPEN C3 H6
3. WZORY SUMARYCZNE WYNIKAJĄ ze wzorów strukturalnych i obecności wiązania podwójnego:
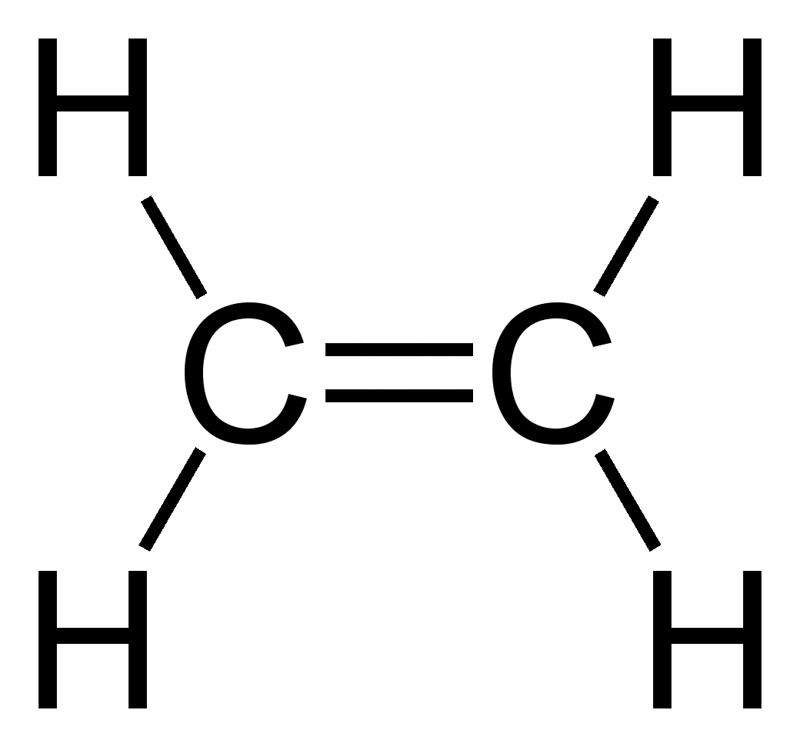
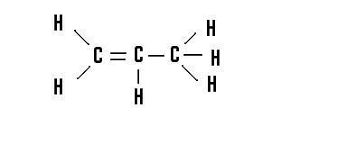
4. Łatwo zauważyć ,że wzór ogólny alkenów to CnH2n
5. Najważniejszym alkenem jest ETEN ( etylen)

– o nim będzie następna lekcja na MTeams.
Koniec 🙂
Lekcja z dn. 25.01.2021r. (8b)i 27.01.2021r.(8a).
Ostatniej doby w wyniku zatrucia tlenkiem węgla zmarła jedna osoba, a osiem wymagało pomocy lekarskiej – poinformowała w środę rano Państwowa Straż Pożarna. W związku z czadem strażacy interweniowali niemal 30 razy.
Z danych przekazanych przez PSP wynika, że od 1 października, czyli od początku obecnego sezonu grzewczego, strażacy wyjeżdżali do 1787 zdarzeń związanych z emisją tlenku węgla. W wyniku zatrucia czadem 775 osób wymagało hospitalizacji, a 33 osoby zmarły, z czego 10 ofiar śmiertelnych zanotowano w tym roku.
Tlenek węgla jest gazem bezwonnym, bezbarwnym i pozbawionym smaku. W układzie oddechowym człowieka wiąże się z hemoglobiną 250 razy szybciej niż tlen, blokując dopływ tlenu do organizmu. Objawami lżejszego zatrucia są ból i zawroty głowy, osłabienie i nudności. Następstwem ostrego zatrucia – przy dużych stężeniach tego gazu – może być nieodwracalne uszkodzenie ośrodkowego układu nerwowego, niewydolność krążeniowo-oddechowa i śmierć.
W związku z zagrożeniem zatrucia tlenkiem węgla Państwowa Straż Pożarna prowadzi kampanię pn. Czujka na straży twojego bezpieczeństwa, w której propagowane są bezpieczne zachowania oraz wiedza o zagrożeniach związanych z czadem. Strażacy zachęcają również do instalowania czujek tlenku węgla ostrzegających o pojawieniu się tego gazu.
Czad powstaje podczas procesu niepełnego spalania materiałów palnych, które występuje przy niedostatku tlenu w otaczającej atmosferze. Ma silne właściwości toksyczne.

Temat: Właściwości fizyczne i chemiczne alkanów.
- Wzory i nazwy do zapamiętania:
.jpg)
2. Właściwości fizyczne węglowodorów nasyconych( alkanów ) zależą od liczby atomów węgla w cząsteczce:
a. Alkany zawierające w cząsteczce od 1 do 4 atomów węgla w cząsteczce to gazy.
Węglowodory nasycone zawierające od 5 do 16 atomów węgla w cząsteczce to ciecze,
a mające 17 i więcej atomów węgla w cząsteczce – substancje stałe.
b) Ze wzrostem długości łańcucha węglowego (wzrost masy cząsteczkowej związków) rośnie gęstość oraz temperatura wrzenia alkanów:
c) alkany są praktycznie nierozpuszczalne w wodzie (rozpuszczalnik polarny – hydrofilowy), bardzo dobrze rozpuszczają się natomiast w rozpuszczalnikach niepolarnych (hydrofobowych), np. w benzynie. A zatem węglowodory nasycone są substancjami hydrofobowymi (nie lubiącymi wody). Zasadę wzajemnego rozpuszczania się substancji można sformułować: „podobne rozpuszcza się w podobnym”.
3. Jako węglowodory nasycone , alkany są bardzo mało aktywne chemicznie; ulegają np. reakcjom spalania i chlorowania( pod wpływem katalizatora).
4. Metan

uzupełnij po obejrzeniu filmu:
właściwości fizyczne metanu: ………………………………..
właściwości chemiczne metanu: …………………………………………
występowanie i otrzymywanie metanu : ……………………………..
zastosowanie metanu : ……………….
Reakcje spalania metanu : ( tłumaczenie na Teamsach )
KONIEC
materiały dodatkowe: https://epodreczniki.pl/a/wlasciwosci-alkanow/D1BRJwaVK
Czytaj więcej na https://opracowania.pl/opracowania/chemia/weglowodory-nasycone-alkany,oid,2190,wlasciwosci-fizyczne#utm_source=paste&utm_medium=paste&utm_campaign=other
Lekcja z dnia 20.01.2021r. i 21.01.2021r. ( 8 a i 8 b)
Temat : Szereg homologiczny alkanów.
Notatka:
1.Szereg homologiczny to zbiór węglowodorów, ustawionych wg wzrastającej liczby atomów węgla w cząsteczce, o podobnej budowie i podobnych właściwościach chemicznych i których własności fizyczne zależą od liczby atomów węgla.
2.Alkany to szereg węglowodorów nasyconych (tzn. takich, w których wszystkie wiązania między atomami węgla są pojedyncze( nasycone); alkany to inaczej szereg metanu( węglowodory podobne do metanu) , w przemyśle nazywane są parafinami.
3. Do szeregu metanu zaliczamy kolejno :
metan CH4
etan C2H6
…..
alkan CnH2n+2
dodatkowy materiał – str. 104-105 , podręcznik
Każdy następny wzór piszemy na podstawie ich wzoru ogólnego CnH2n+2
4. Wzory ogólne , strukturalne, grupowe, skrócone – przykłady jak podczas lekcji na Mteams,
np. :
CH3-( CH2)8-CH3 – wzór grupowy skrócony dekanu czyli C10H22
5. Ćwiczenie 1
Oblicz zawartość procentową węgla w metanie .
% C (CH4) = mc/ mCH4 . 100% = 12u/16u . 100% = 75 %
lub z proporcji:

Praca domowa: Oblicz zawartość % węgla w butanie. ( nic nie odsyłamy , praca domowa w zeszycie)
Poniżej filmiki utrwalające wiedzę z lekcji na MTeams.
CHEMIA ORGANICZNA
lekcja z dn. 17.12 2020r (8a i 8b)
Temat: Źródła węglowodorów; organiczne związki węgla.
Notatka :
1. Węglowodory, to organiczne połączenie węgla i wodoru, takie w których węgiel jest zawsze IV- wartościowy i może wytwarzać między swoimi atomami wiązania pojedyncze, podwójne i potrójne, tworząc długie łańcuchy proste, łańcuchy rozgałęzione, pierścienie oraz pierścienie z łańcuchami bocznymi:
PRZYKŁADY NAZW I WZORÓW:

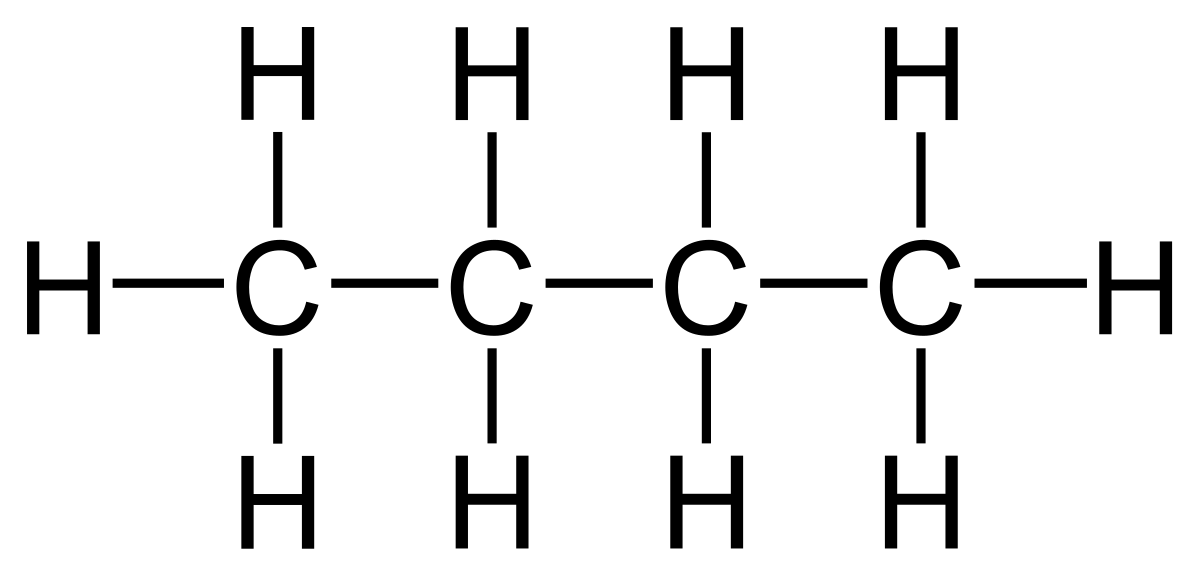


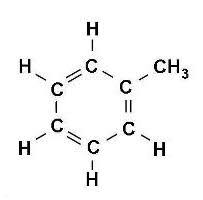
( tylko przeczytaj – nie przepisuj ! Z tych kilku prostych przykładów wynika ciekawostka ! -Szacuje się, że liczba opisanych dotąd związków organicznych przekroczyła już 10 milionów i rocznie zwiększa się o ok. 200 tysięcy. Ta mnogość związków organicznych wynika ze zdolności atomów węgla do tworzenia wiązań zarówno między własnymi atomami, jak i z atomami większości innych pierwiastków chemicznych; prowadzi to do powstawania cząsteczek o dowolnie dużej liczbie atomów, powiązanych ze sobą w łańcuchy i/lub pierścienie, różniące się między sobą (w przypadku takiego samego składu ilościowego i jakościowego) dodatkowo kolejnością wiązań oraz geometrycznym i/lub przestrzennym ułożeniem atomów w cząsteczce (tzw. zjawisko izomerii).
2. Naturalnymi źródłami węglowodorów są: gaz ziemny, ropa naftowa i węgle kopalne.
obejrzyj filmy i napisz krótko :
Pochodzenie : węgla kamiennego –
ropy naftowej –
gazu ziemnego-
3.Zastosowanie produktów przerobu węgla i ropy.
obejrzyj i wypisz 10 zastosowań :

koniec 🙂
Lekcja nr 11 z dn. 14(8b) i 16(8a) grudnia.
Dziś tylko jedno ćwiczenie – jako przygotowanie do pracy w czwartek, 17 grudnia;wszystkim którzy odeślą to ćwiczenie mogę je sprawdzić przed pracą na zaliczenie
1.Wszystkimi możliwymi sposobami otrzymaj chlorek sodu.
.Podpowiedź : zapisz schematy słowne i dopasuj reakcję ,jeżeli tą metodą nie można otrzymać soli, zapisz „ nie zachodzi”
Lekcja nr 10 z dn. 09.12.2020r.
Temat: Zaprawa wapienna i zaprawa gipsowa.
1. Pochodzenie skał wapiennych.
Skały to zespoły minerałów, czyli pierwiastków i związków chemicznych występujących w przyrodzie.Skały wapienne powstawać mogą w wyniku nagromadzenia się węglanowych szczątków zwierząt( np. powstają w wyniku nagromadzenia się dużych ilości węglanowych szkieletów gąbek, koralowców , skorup i muszli otwornic, małżów, ślimaków, ramienionogów lub głowonogów), niekiedy również roślin, na dnie zbiorników morskich i śródlądowych oraz w wyniku wytrącenia węglanu wapnia z roztworów wodnych.
Głównym składnikiem skał wapiennych jest kalcyt, czyli CaCO3 (węglan (IV) wapnia).
Skały wapienne:
– wapień
– kreda
– marmur
I etap produkcji to znalezienie i identyfikacja surowca do produkcji zaprawy, którym jest węglan wapnia:

1 cząsteczka węglanu wapnia reaguje z 2 cząsteczkami kwasu solnego.
W wyniku reakcji powstaje 1 cząsteczka chlorku wapnia oraz 1 cząsteczka kwasu węglowego, który jest nietrwały i rozkłada się na 1 cząsteczkę wody i 1 cząsteczkę dwutlenku węgla.
Wydzielający się dwutlenek węgla powoduje pienienie.
Jest to reakcja charakterystyczna, pozwalająca odróżnić skały wapienne od innych skał.
II etap to

Jedna cząsteczka węglanu wapnia rozkłada się na jedną cząsteczkę tlenku wapnia i jedną cząsteczkę dwutlenku węgla.
CaO – wapno palone (nazwa potocznie przyjęta)
III etap :
Wapno palone bardzo energicznie reaguje z wodą, przy czym wydziela się duża ilość ciepła. Jest to reakcja egzoenergetyczna.

Jedna cząsteczka tlenku wapnia reaguje z jedną cząsteczką wody i powstaje wodorotlenek wapnia.
Proces ten nazywa się gaszeniem wapna, a wodorotlenek wapnia nazywamy wapnem gaszonym.
Ca(OH)2 – wapno gaszone
Świeża zaprawa zawiera piasek, wodę i wapno gaszone.
IV Etap
Twardnienie zaprawy murarskiej zachodzi pod wpływem dwutlenku węgla zawartego w powietrzu.

Schemat procesu :
Źródło: https://opracowania.pl/opracowania/chemia/skaly-wapienne,oid,2113
Zaprawa gipsowa –

to omówimy jutro na Teamsach
Pojęcia konieczne : skała, skała wapienna , złoże, eutrofizacja, wapno palone, wapno gaszone, twardnienie zaprawy, gips, gips palony, sole uwodnione (hydraty)
Lekcja nr 9 z dnia 7 grudnia ( 8b) i 9 grudnia ( 8a)
9.12 Mteams
Temat: Zastosowanie wybranych soli.
źródło : https://epodreczniki.pl
1. Występowanie soli w przyrodzie


Węglany są liczną grupą minerałów. Anion węglanowy może tworzyć w nich połączenia z kationami metali, takich jak magnez, żelazo, wapń, cynk, mangan, ołów, miedź. Często towarzyszą złożom lub same stanowią źródło ważnych metali



Ciekawostka
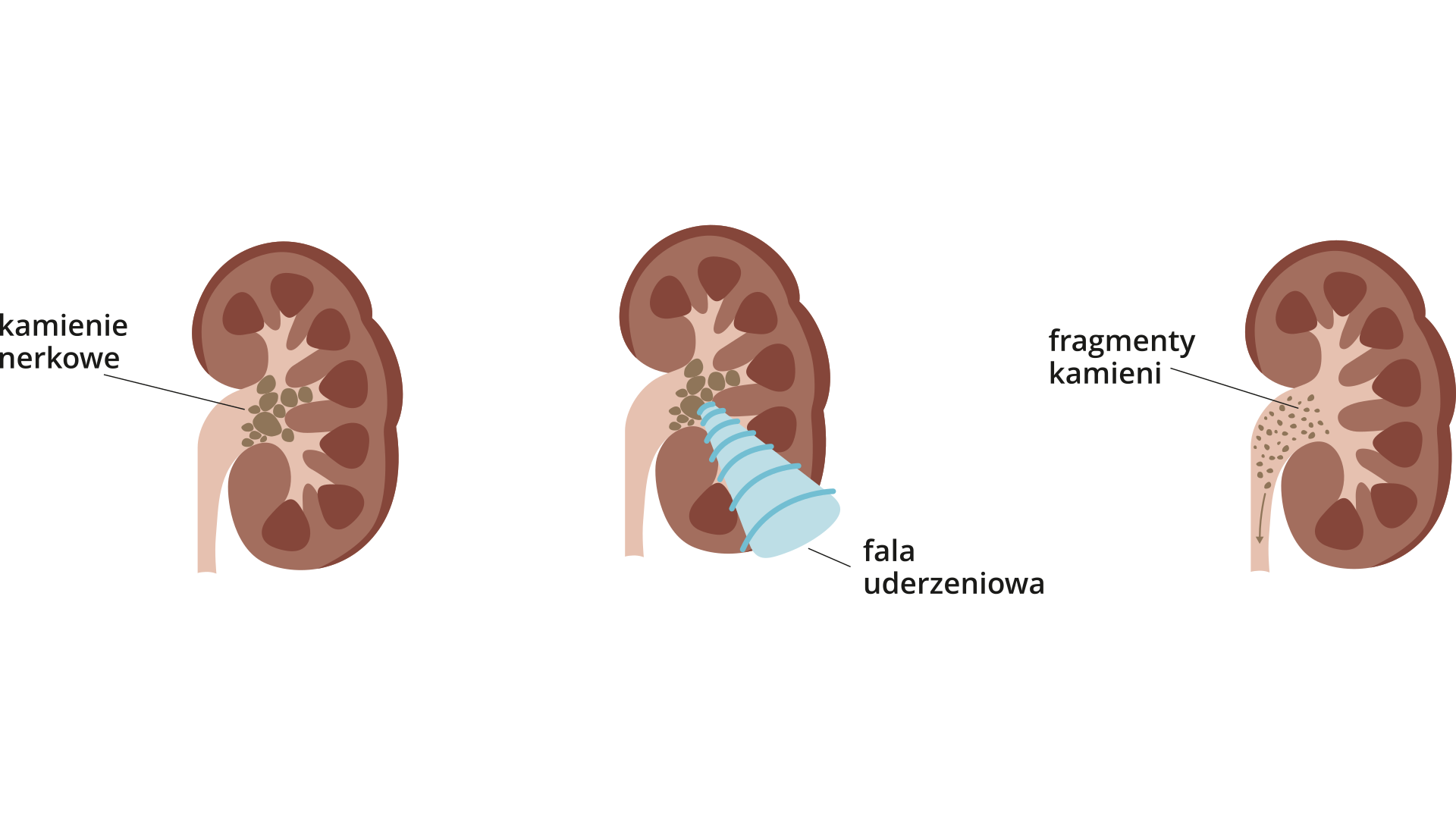
Kamienie nerkowe
Niektóre sole mogą wytrącać się w drogach moczowych organizmu ludzkiego. Złogi te potocznie nazywa się kamieniami nerkowymi. Tworzą je głównie fosforany(V), szczawiany (pochodne kwasu szczawiowego) i moczany (pochodne kwasu moczowego). Podczas leczenia stosuje się odpowiednią dietę i leki rozpuszczające kamienie. Podejmuje się też próbę rozbijania ich za pomocą ultradźwięków.
2. Zastosowanie węglanów


3. Zastosowanie azotanów(V)

4. Zastosowanie siarczanów(VI)

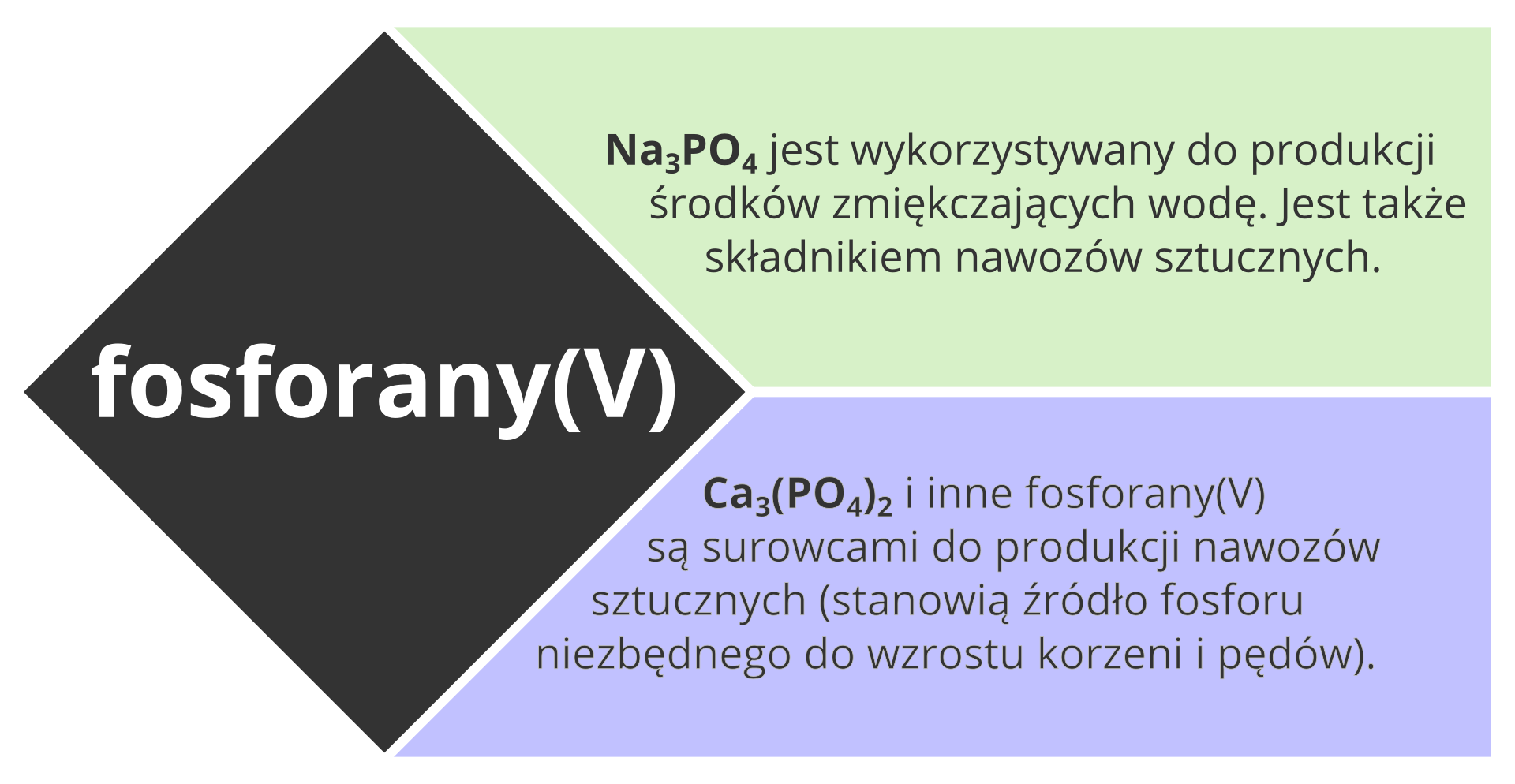
5. Zastosowanie fosforanów(V)
6. Zastosowanie chlorków

Ciekawostka
Naturalne wody zawierają rozpuszczone w nich sole pochodzące ze skał, które spotykają po drodze. Niektóre z nich mają dużo rozpuszczonych soli (w ilości co najmniej 1 g w 1 dmIndeks górny 33), które w odpowiednich proporcjach wywierają korzystne działanie na organizm ludzki. Te wody nazwano mineralnymi. Jonami najczęściej występującymi w wodach mineralnych są: Mg2+, Ca2+, Na+, K+,Cl−, SO42− , CO32− .
7. Wpływ soli na środowisko
Niektóre sole w wyniku działalności człowieka zostają wprowadzone do środowiska, wywołując zachwianie istniejącej równowagi. Na przykład substancje wykorzystywane do produkcji nawozów sztucznych i środków czystości dostają się do wód, powodując ich degradację. Chlorek sodu, którym w czasie zimy posypuje się drogi, oddziałuje negatywnie na rośliny i gleby znajdujące się w pobliżu szos.


Wody spływające z nawożonych pól oraz ścieki przenoszą do zbiorników wodnych substancje, które zawierają azot i fosfor, czyli pierwiastki chemiczne pobudzające rozwój roślin wodnych. Wzrost składników odżywczych w jeziorach wywołuje znaczny rozwój glonów (tzw. kwitnienie wody), które sprawiają, że woda staje się mętna, ma niedobry smak i nieprzyjemny zapach. Glony ograniczają także dostęp światła do głębszych warstw jeziora, powodując zanikanie fotosyntezy u roślin (przez co nie następuje produkcja tlenu) i ich obumieranie.
Po pewnym czasie także glony obumierają i opadają na dno zbiornika. Tam następuje rozkład materii pod wpływem bakterii, a w procesie tym zużywany jest tlen. W krótkim czasie pojawia się deficyt tlenu i rozpoczynają się procesy gnilne. Nowe warunki nie sprzyjają rozwojowi zwierząt wodnych dotychczas żyjących w jeziorze i ich liczebność gwałtownie spada. Warstwa materii organicznej zalegającej na dnie zbiornika staje się coraz większa, powodując podnoszenie się poziomu dna, a jezioro stopniowo zanika.


Ciekawostka
Eutrofizacja
Zjawisko polegające na zwiększeniu żyzności wód w zbiorniku wodnym i jego skutki nazywane są eutrofizacją. Proces ten jest naturalny i zachodzi bardzo powoli od początku istnienia jeziora. Jednak nienaturalny wzrost składników odżywczych w jeziorze znacznie nasila to zjawisko i powoduje degradację akwenu.
Podsumowanie
- Sole występują w przyrodzie w formie rozpuszczonej w wodach naturalnych lub tworzą minerały.
- Azotany(V) i fosforany(V) są wykorzystywane m.in. do produkcji nawozów sztucznych.
- Węglan wapnia jest np. surowcem do produkcji materiałów budowlanych.
- Chlorek sodu jest używany m.in. do celów spożywczych, w przemyśle farmaceutycznym oraz do posypywania zaśnieżonych ulic zimą.
Praca domowa: jakie zastosowanie ma azotan(V) srebra?
Lekcja nr 8 z dnia 3 grudnia – Mteams ( 8a i 8b)
Temat pozostałe reakcje otrzymywania soli.
Dziś dwie ostatnie metody otrzymywania soli:
VIII. Reakcja typu :
Tlenek metalu + tlenek niemetalu = sól
przykład 1: Na2O + SO3 = Na2SO4
SO3 czyli tlenek siarki (VI) jest bezwodnikiem kwasu siarkowego (VI) i w środowisku wodnym reakcji wprowadzi do soli anion reszty kwasowej SO42-.
przykład 2 :
CaO + N2O5 = 2 Ca NO3 ( tlenek azotu (V) jest bezwodnikiem kwasu azotowego (V) i wprowadza do soli anion NO3– )
tą metodą można otrzymać tylko sole kwasów tlenowych.
IX . Reakcja typu
metal + niemetal = sól
przykład: 2Na + Cl2 = 2 NaCl reakcja syntezy bezpośredniej ; można tak otrzymywać tylko sole kwasów beztlenowych ( siarczki, chlorki, jodki, bromki, fluorki).
Wszystkie metody otrzymywania soli wraz z przykładami ( powtórzenie ) są w podręczniku, str. 95.
Wkrótce powtórzenie i kartkówka., zajrzyjcie na : https://pistacja.tv/wideolekcje/chemia/szkola-podstawowa-vii-viii/sole/plchm008-sole
Lekcja nr 7, 30.11.2020r(8b) i 2.12.2020r.(8 a)
Temat : Pozostałe reakcje otrzymywania soli – reakcje strąceniowe.
Reakcje strąceniowe, to reakcje wymiany; przeprowadzenie ich ma sens wtedy, gdy z roztworu po reakcji wytrąca się w postaci osadu sól nierozpuszczalna w wodzie, możemy ją wtedy oddzielić przez sączenie .
Metody strąceniowe służą do otrzymywania soli oraz wodorotlenków, których nie uda się otrzymać poprzednimi metodami.
Schematy słowne tych reakcji:
V. sól I + wodorotlenek I= sól II + wodorotlenek II
przykład :
VI. sól 1 + kwas I = sól II + kwas II
przykład
VII . sól I + sól II = sól III + sól IV
przykład
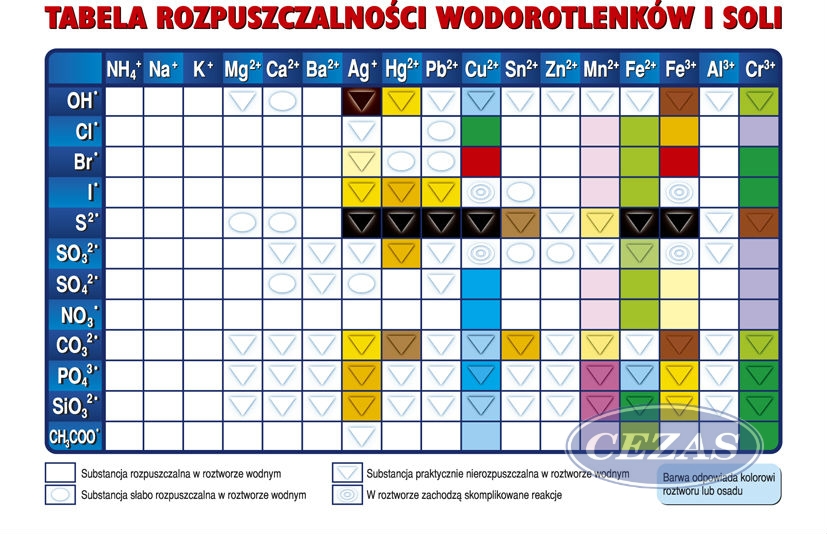
Przykłady omówimy na Teamsach – proszę mieć już przepisaną notatkę z miejscem na przykłady oraz przygotowaną tablicę rozpuszczalności soli.
Reakcje strąceniowe można zapisać następująco :

Otrzymywanie osadu trudno rozpuszczalnego wodorotlenku glinu :
Aby w reakcji wytrącił się osad wodorotlenku glinu, musimy wziąć do reakcji roztwór dobrze rozpuszczalnego związku zawierającego kation glinu (np. AlCl3 korzystamy w tym celu z tablicy rozpuszczalności) oraz roztwór dobrze rozpuszczalnego wodorotlenku, np. NaOH.

Czytaj więcej na https://opracowania.pl/opracowania/chemia/reakcje-w-roztworach-wodnych,oid,2188,reakcje-straceniowe#utm_source=paste&utm_medium=paste&utm_campaign=other
Podręcznik – strona 80 -82.
Praca domowa – czas odesłania przez TEAMSY do piątku, 4 grudnia , godz. 22.00
- dla wszystkich : zapisz reakcje cząsteczkowe zachodzące między: a. wodorotlenkiem potasu a chlorkiem cynku, b. azotanem (V) magnezu a kwasem fosforowym (V) , c. azotanem (V) srebra (I) a chlorkiem glinu; zaznacz wytrącający się produkt.
- dla chętnych grupa A z linku : https://www.dlanauczyciela.pl/pliki/zasoby,reforma-2017-szkola-podstawowa-klasy-4-8,chemia,chemia-nowej-ery?path=klasa-8,sole
Pozdrawiam 🙂
Przypominam wszystkim o kartkówce – sole ( wzory i nazwy, definicje, dysocjacja soli , 3 metody otrzymywania soli) – wpisane w mobidziennik.
Lekcja nr 6 z dnia 23.11.2020r(8b)i25.11.2020r.(8a)
Temat:Reakcje wodorotlenków metali z tlenkami niemetali.
IV metoda otrzymywania soli,to reakcja wg schematu słownego:
Wodorotlenek + tlenek niemetalu = sól + woda
Przykład 1 :
2 NaOH + SO3 = Na2SO4 + H2O – w tej reakcji tlenek niemetalu ( tlenek kwasowy , bezwodnik kwasowy )pełni rolę kwasu i wprowadza do soli anion kwasu ,którego jest bezwodnikiem- pamiętamy,że reakcje zachodzą w roztworach wodnych:
SO3 + H2O = H2SO4
Co trzeba umieć ( powtórzyć) aby zapisywać te reakcje ??? – przede wszystkim wzory kwasów i ich bezwodników ( tlenków niemetali, z których powstają w wyniku reakcji z wodą).
Przykład 2:
2 KOH + N2O5 = 2KNO3 + H2O– napiszemy tą reakcję , jeśli pamiętamy, że N2v O5II w środowisku reakcji wytworzy kwas azotowy(V) i wprowadzi do soli anion NO3– .
Metodą tą można otrzymać tylko sole kwasów tlenowych.
Podręcznik , strona 79.- to teoria, prace domową zadam na TEAMSACH.
Koniec lekcji nr 6
Pozdrawiam 🙂
Lekcja nr 5 z dnia 16.11 (8b) i 18.11.(8a)
Temat: Reakcje tlenków metali z kwasami jako III metoda otrzymywania soli.
Dziś do wyćwiczenia III metoda otrzymywania soli, której schemat słowny wygląda następująco:
III. tlenek metalu + kwas = sól + woda
przykład: Na2O + 2HCl = 2NaCl+ H2O ; można to wytłumaczyć, że tlenek metalu pełni rolę wodorotlenku ( tak jak w reakcji zobojętniania, reakcja przebiega w środowisku wodnym, więc tlenek reaguje z wodą dając wodorotlenek który natychmiast reaguje z kwasem ).
Sole są zbudowane z metalu i reszty kwasowej i o tym musimy pamiętać układając reakcje wg tego schematu:
3CaO + 2 H3PO4 =Ca3(PO4 )2+3 H20
Ca3(PO4 )2 – to fosforan(V) wapnia ;możemy go otrzymać III sposobami:
:
I. wodorotlenek + kwas = ………………+ …………………
. ……………….. + ……………….. = ………………….+ ………………….
II. metal + kwas = ……………….. + …………………
…………………. + ………………. = ……………………. + ………………
III. tlenek metalu + kwas = ………………. + ………………….
………………… + …………………… = ……………. + ………………….
Reszta przykładów na teamsach
polecam link : https://epodreczniki.pl/a/reakcja-tlenkow-z-kwasami-i-zasadami/D1ESwTrrp
www.pi-stacja.pl
Koniec lekcji nr 5 .
Lekcja nr 4 z dnia 09.11.2020r.(8b)i 12.11.2020(8a)
Temat: Reakcje kwasów z metalami.
I.Reakcje kwasów z metalami to druga metoda otrzymywania soli ;aby je poprawnie zapisywać , musimy mieć opanowane z poprzednich lekcji : wzory i nazwy soli, budowa soli , wyróżnianie części pochodzących od wodorotlenków i kwasów.

II.Sole mogą powstawać w reakcjach bezpośredniego działania kwasów na niektóre metale:
inne przykłady:
2Na + 2HCl = NaCl + H2 – aktywny sód wypiera wodór z cząsteczki kwasu;
schemat słowny tej reakcji:
metal+ kwas = sól + wodór
Czy wszystkie metale reagują w ten sposób? – Nie, ale przewidzieć to możemy posługując się tzw. szeregiem aktywności metali ( podręcznik, str. 75), lub poniżej:

Przykładowo: Ca +2 HCl = CaCl2 + H2 – reakcja zachodzi,wapń jest w szeregu „przed „wodorem, ale reakcja Hg + H2SO4 – nie zachodzi, rtęć jest mało aktywna chemicznie i nie zastąpi wodoru w kwasach.
Wyjątkowo przebiega reakcja miedzi (Cu) z kwasem azotowym (V)
Miedź reaguje z kwasem azotowym (V) mimo , iż w szeregu aktywności leży za wodorem. HNO3 to kwas utleniający ( zawiera tlen w cząsteczce).
praca domowa w zeszycie – dla wszystkich :
Do samodzielnego opracowania : 1.czy glin reaguje z kwasami? 2.co to jest pasywacja? 3. co to jest >>woda królewska<<? – NIE ODSYŁAMY
Przed lekcją na Teamsach czwartek , 12 listopada 2020r. poćwicz: zad. 1 str 76 ( podręcznik)
Reszta na Teamsach czwartek , 12 listopada 2020r.
koniec lekcji nr 4
praca domowa z dnia 5.11.2020 – zadanie 3 str.68- podręcznik
Lekcja nr 3 z 04.11. (8a) i 05.11.( 8b) w planie ( teamsy -środy)
Temat : Pisanie równań reakcji zobojętniania i dysocjacji soli .

Przypomnienie : Reakcja zobojętniania to reakcja wodorotlenku( zasady) z kwasem, w jej wyniku powstaje sól i woda.
Reakcja dysocjacji polega na rozpadzie cząsteczki elektrolitu pod wpływem wody ; sole dysocjują na kationy metali i aniony reszt kwasowych.

Reszta na teamsach 🙂
sprawdź quiz ;
https://www.mauthor.com/present/4731121513398272
lekcja nr 2 29.10.2020r 8a i 8b
Temat : Wzory i nazwy soli, cd.
Nazwy systematyczne soli tworzymy od nazw anionów reszt kwasowych i nazwy kationu, np.: Ca (NO3 )2 , 2 stojąca za nawiasem podwaja ilość reszt kwasowych , nazwa : azotan(v) wapnia.
https://www.youtube.com/results?search_query=wzory+i+nazwy+soli
Powyżej link do filmu oglądanego na lekcji
w ramach ćwiczeń proszę powtórzyć układanie wzorów i nazw soli :ćwiczenia z podręcznika : 1 i 2 , str. 63 podręcznik
Chemia , 28.10.2020
Lekcja 1.
( dzisiejsza notatka tylko dla klasy 8 b, bo 8 a już ją ma).
- Doświadczenie : badamy reakcję między wodorotlenkiem sodu i kwasem solnym( chlorowodorowym); reakcja jest kontrolowana fenoloftaleiną:
Wnioski:
- Zaszła reakcja między kwasem i wodorotlenkiem
- w roztworze nie ma już wodorotlenku, ponieważ zanikła barwa różowo-malinowa fenoloftaleiny
- w roztworze nie ma już kwasu – papierek uniwersalny nie zmienia barwy
- roztwór ma odczyn obojętny, pH=7
- w wyniku reakcji nastąpiło zobojętnienie roztworu
- w wyniku reakcji powstała sól i woda
schemat reakcji:
wodorotlenek + kwas = sól + woda
NaOH + HCl = NaCl + H2O
NaCl to chlorek sodu ( sól kuchenna, sól kamienna)
Produkty reakcji między wodorotlenkami a kwasami nazywamy ogólnie SOLAMI a reakcję nazywamy reakcja zobojętniania( inaczej neutralizacji)
Definicja : Sole to związki chemiczne zbudowane z kationów metalu i anionów reszty kwasowej .
koniec lekcji. 🙂